2021-2022學年北京市豐臺區高二(上)期中化學試卷(B卷)
發布:2024/12/7 19:0:1
一、選擇題(共14小題,每小題3分,每小題只有1個符合題意的選項)
-
1.對裝置或過程能實現電能轉化為化學能的是( )
A B C D 



太陽能電池 燃氣燃燒 電池充電 水力發電 A.A B.B C.C D.D 組卷:29引用:4難度:0.7 -
2.下列過程中,化學反應速率的增大對人類有益的是( )
A.氨的合成 B.食物腐敗 C.塑料的老化 D.金屬的腐蝕 組卷:213引用:17難度:0.7 -
3.25℃和1.01×105Pa時,反應2N2O5(g)═4NO2(g)+O2(g)△H=+56.76kJ?mo-1,自發進行的原因是( )
A.吸熱反應 B.放熱反應 C.熵減少的反應 D.熵增效應大于熱效應 組卷:105引用:7難度:0.8 -
4.1g冰受熱轉化為1g水蒸氣,下列分析不正確的是( )
A.該過程是熵增的過程 B.該過程發生的是物理變化 C.1g冰與1g水蒸氣所具有的內能不同 D.H2與O2反應生成1molH2O(l)與生成1molH2O(g)放出的熱量相同 組卷:22引用:5難度:0.8 -
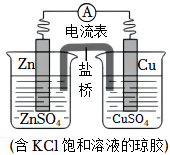 5.鋅銅原電池裝置如圖,下列說法不正確的是( )
5.鋅銅原電池裝置如圖,下列說法不正確的是( )A.鋅電極上發生氧化反應 B.電子從鋅片經電流計流向銅片 C.鹽橋中Cl-向正極移動 D.銅電極上發生反應:Cu2++2e-═Cu 組卷:87引用:5難度:0.7 -
6.下列事實中,與電化學腐蝕無關的是( )
A.用銅質鉚釘鉚接鐵板,鐵板易被腐蝕 B.為了保護海輪的船殼,常在船殼上附加鋅塊 C.在空氣中,銀器表面會生成一層黑色的物質 D.埋在潮濕土壤里的鐵管比埋在干燥土壤里的鐵管更容易被腐蝕 組卷:69引用:8難度:0.7
二、第II部分(非選擇題共58分)
-
 18.降低能耗是氯堿工業發展的重要方向。
18.降低能耗是氯堿工業發展的重要方向。
(1)我國利用氯堿廠生產的H2作燃料,將氫燃料電站應用于氯堿工業,其示意圖如圖。
①a極為(填“正”或“負”)極。
②乙裝置中電解飽和NaCl溶液的化學方程式為。
③下列說法正確的是。
A.甲裝置可以實現化學能向電能轉化
B.甲裝置中Na+透過陽離子交換膜向a極移動
C.乙裝置中c極一側流出的是淡鹽水
④結合化學用語解釋d極區產生NaOH的原因:。
⑤實際生產中,陽離子交換膜的損傷會造成OH-遷移至陽極區,從而在電解池陽極能檢測到O2,產生O2的電極反應式為。下列生產措施有利于提高Cl2產量、降低陽極O2含量的是。
A.定期檢查并更換陽離子交換膜
B.向陽極區加入適量鹽酸
C.使用Cl-濃度高的精制飽和食鹽水為原料
(2)降低氯堿工業能耗的另一種技術是“氧陰極技術”。通過向陰極區通入O2,避免水電離的H+直接得電子生成H2,降低了電解電壓,電耗明顯減少。“氧陰極技術”的陰極反應為。組卷:80引用:10難度:0.6 -
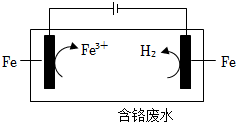 19.電鍍工業往往產生含CrO42-、Cr2O72-的含鉻廢水,排放前須將二者還原為Cr3+,之后再加堿沉淀出Cr(OH)3,經處理后廢水中鉻的含量顯著降低。
19.電鍍工業往往產生含CrO42-、Cr2O72-的含鉻廢水,排放前須將二者還原為Cr3+,之后再加堿沉淀出Cr(OH)3,經處理后廢水中鉻的含量顯著降低。
(1)CrO42-、Cr2O72-中,鉻(Cr)元素的化合價為。
(2)化學平衡2CrO42-+2H+?Cr2O72-+H2O K=4.2×1014。
體系中c(H+)=0.01mol?L-1時,比較c(Cr2O72-)、c(CrO42-)的大小:。
(3 )化學還原法處理含鉻廢水
ⅰ.向廢水中加入H2SO3(二元弱酸;SO2溶于水即得H2SO3)。
①H2SO3的電離常數Ka1的表達式為。
②將Cr2O72-轉變為Cr3+,利用了H2SO3的酸性和性。
ⅱ.投加生石灰,將Cr3+沉淀為Cr(OH)3。
(4)電解還原法處理酸性含鉻廢水:以鐵板做陰、陽極,電解含鉻廢水,示意如圖。
①陽極電極反應:Fe-2e-═Fe2+。產生的Fe2+將Cr2O72-還原為Cr3+的離子方程式為。
②陰極區的pH(填“增大”或“減小”),使Cr3+、Fe3+形成Cr(OH)3、Fe(OH)3沉淀。
③隨著電解的進行,陽極鐵板會發生鈍化,表面形成FeO?Fe2O3的鈍化膜,使電解池不能正常工作。將陰極鐵板與陽極鐵板交換使用,一段時間后,鈍化膜消失。結合有關反應,解釋鈍化膜消失的原因:。組卷:34引用:3難度:0.5


