2021年江蘇省百校聯考高考化學第三次考試試卷
發布:2024/12/27 4:0:3
一、單項選擇題:共13題,每題3分,共39分。每題只有一個選項最符合題意。
-
1.化學和生活、生產息息相關。下列說法正確的是( )
A.軍用充電發熱馬甲主要涉及電能、化學能、熱能之間的轉化 B.腺病毒重組新冠疫苗性質穩定,可以高溫下運輸、保存 C.海水稻含有豐富的蛋白質、脂肪、淀粉等高分子營養物質 D.納米鐵粉可以吸附除去污水中的Cu2+、Hg2+等重金屬離子 組卷:78引用:2難度:0.9 -
2.CO和O在釘催化劑的表面有“線式”和“橋式”兩種反應方式,其中“線式”反應在催化劑表面形成化學鍵的過程如圖所示,下列說法正確的是( )

A.CO2和CO都能與堿反應生成鹽和水 B.該過程中,CO先斷鍵成C和O C.狀態Ⅰ→狀態Ⅲ是放熱過程 D.釘催化劑降低了該反應的焓變 組卷:34引用:3難度:0.5 -
3.下列氧化物的性質與用途具有對應關系的是( )
A.SO2具有漂白性,可用作溴蒸氣的吸收劑 B.CaO具有堿性氧化物的性質,燃煤中加入CaO可以減少酸雨的形成 C.Al2O3是兩性氧化物,可以用作防腐涂層 D.MgO熔融狀態下能導電,可以用作耐火材料 組卷:92引用:3難度:0.9 -
4.閱讀下列資料,完成4-6題:高純氯氣和氟化氫是電子芯片、通訊技術產業中的基礎物質。近年來以美國為首的西方國家對我國高科技企業無端的打壓、限制,我國已開啟了高純氯氣和氟化氫工業化時代。高純氯氣是制備高純硅的基礎物質。電子級HF用于集成電路(IC)芯片的清洗,能夠清洗芯片表面硅氧化物(SiO2+4HF═SiF4↑+2H2O)。
關于SiO2+4HF═SiF4↑+2H2O的反應和粒子的說法正確的是( )A.該反應屬于氧化還原反應 B.SiF4的電子式: 
C.沸點:HCl<HF D.SiF4和SiO2晶體類型相同 組卷:12引用:0難度:0.50 -
5.閱讀下列資料,完成4-6題:高純氯氣和氟化氫是電子芯片、通訊技術產業中的基礎物質。近年來以美國為首的西方國家對我國高科技企業無端的打壓、限制,我國已開啟了高純氯氣和氟化氫工業化時代。高純氯氣是制備高純硅的基礎物質。電子級HF用于集成電路(IC)芯片的清洗,能夠清洗芯片表面硅氧化物(SiO2+4HF═SiF4↑+2H2O)。
下列有關工業制取氯氣的敘述正確的是( )A.2NaCl+2H2O H2↑+Cl2↑+2NaOH△S>0可自發進行通電B.陽極產物能使濕潤的淀粉碘化鉀試紙變藍 C.電解時陰、陽兩極材料可以選用鐵、銅 D.生成22.4L的氫氣,轉移的電子數目約為2×6.02×1023 組卷:6引用:0難度:0.60
二、非選擇題:共4題,共61分。
-
16.鐵的化合物在生產生活中應用廣泛。工業上用廢鐵屑或煉鐵廢渣(主要成分Fe、Fe2O3和少量CuO)制備硫酸亞鐵,以硫酸亞鐵為原料制備水處理劑——聚合硫酸鐵[Fe2(OH)n(SO4)(3-0.5n)]m。
(1)利用廢鐵屑(含少量FeS)制備聚合硫酸鐵的裝置如圖(支撐裝置略):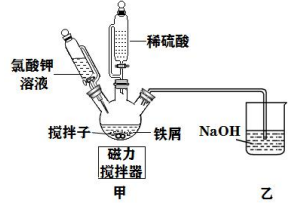
①溶解:先用10%的碳酸鈉溶液煮沸廢鐵屑,再用清水洗凈,將處理好的鐵屑放入裝置中,組裝儀器,加入適量稀硫酸溶解;硫酸用量不能過多,原因是;
②合成:待鐵屑反應完全后,分批注入氯酸鉀溶液并攪拌,放置一段時間;寫出KClO3、FeSO4、H2SO4攪拌生成Fe2(OH)n(SO4)(3-0.5n)的化學反應方程式。
③檢驗:檢驗甲裝置中亞鐵離子減少到規定濃度即可結束反應,制得產品。
(2)為了確定Fe2(OH)n(SO4)(3-0.5n)的組成,設計如下實驗。
步驟一:取聚合硫酸鐵樣品25.00mL,加入足量的BaCl2溶液,產生白色沉淀,過濾、洗滌、干燥,稱重,沉淀質量為2.9125g。
步驟二:另取25.00mL聚合硫酸鐵樣品,加入足量銅粉,充分反應后過濾、洗滌,將濾液和洗液合并配成250.00mL溶液,取該溶液25.00mL,用酸性KMnO4溶液滴定,到達終點時用去0.0100mol?L-1 KMnO4標準溶液20.00mL,求:Fe2(OH)n(SO4)(3-0.5n)組成。(寫出計算過程)
(3)用煉鐵廢渣制備硫酸亞鐵晶體,請補充完整實驗方案:
已知:溶液中各離子開始沉淀和沉淀完全的pH值
取一定量的煉鐵廢渣,加入適量的1.0mol?L-1硫酸充分溶解,Fe2+ Fe3+ Cr3+ Cu2+ 開始沉淀 pH 7.6 2.3 4.5 4.4 沉淀完全 pH 9.1 3.3 5.6 6.4 將濾液蒸發濃縮,冷卻結晶,過濾,洗滌,干燥得硫酸亞鐵晶體(FeSO4?7H2O)。(必選的試劑1.0mol?L-1 H2SO4溶液、3%H2O2溶液、1.0mol?L-1 NaOH溶液、還原鐵粉)組卷:57引用:1難度:0.5 -
17.SO2和氮氧化物(NOx)都是空氣污染物,科學處理及綜合利用是環境科學研究的熱點。
(1)某科研小組研究不同條件下0.4mol?L-1(NH4)2S溶液常壓下吸收SO2煙氣的吸收率。
①溶液pH:隨著含SO2煙氣的不斷通入,SO2和硫的吸收率如圖1所示:
ⅰ:當pH=10-8.6,硫的總吸收率不斷減小,因為S2-濃度較高與SO2反應,生成S,同時產生大量的導致硫的總吸收率減小。
ⅱ:當pH=8-3,硫的總吸收率增大,生成的主要產物為(NH4)2S2O3和NH4HSO3。(NH4)2S2O3和NH4HSO3一定條件下反應,生成硫磺和(NH4)2SO4最終回收,反應的化學方程式為。
ⅲ:當pH<3時,導致SO2和硫的總吸收率降低。
②溫度:如圖2所示,該項目選擇常溫,一是為了節能,另一個原因是。
③其他條件:。(任舉一例)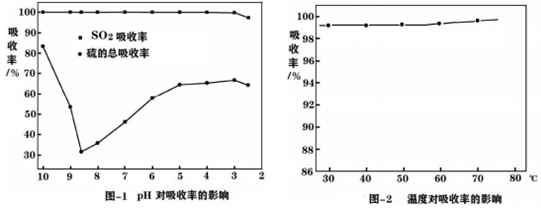
(2)聯合脫硫脫硝技術,是一種工業工藝技術,采用“35%的氯酸(HClO3)同時脫硫脫氮技術”,處理煙氣(含SO2、NO)可獲得H2SO4、HCl、HNO3副產品,通過實驗發現,當氯酸的濃度小于35%時,SO2和NO的脫除率幾乎不變,但生成HNO3的量遠小于理論值,可能的原因是。組卷:59引用:1難度:0.6


