2022-2023學年江西省宜春市豐城中學高三(上)期中化學試卷
發布:2024/8/30 4:0:9
一、單選題(每小題3分,共48分)
-
1.下列對物質的主要用途、原因解釋的描述都正確的是( )
選項 物質 主要用途 原因解釋 A 晶體硅 高純硅可用于制備光導纖維、光電池、集成電路和計算機芯片 硅是良好的半導體材料 B 金屬鋁 高鐵車廂采用鋁合金材料 鋁與氧氣不反應 C 氯氣 與石灰乳或燒堿反應制備消毒劑 氯氣有強氧化性 D 金屬鈉 高溫時能從熔融TiCl4中置換出金屬Ti 鈉具有很強的還原性 A.A B.B C.C D.D 組卷:16引用:6難度:0.7 -
2.《本草綱目》“燒酒”寫道:“自元時始創其法,用濃酒和糟入甑,蒸令氣上…其清如水,味極濃烈,蓋酒露也”。若在實驗室里完成文中操作,不需要的儀器是( )
A. 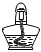
B. 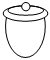
C. 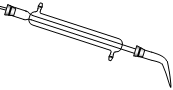
D. 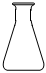 組卷:84引用:10難度:0.7
組卷:84引用:10難度:0.7 -
3.下列實驗中不能達到實驗目的的是( )
A. 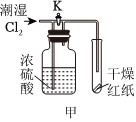
裝置甲可用于驗證潮濕氯氣與干燥氯氣的漂白性B. 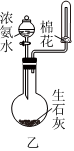
利用圖乙制取并收集少量的NH3C. 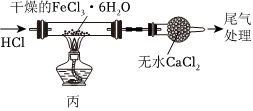
用丙裝置制備無水FeCl3D. 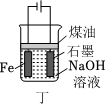
用丁裝置制備Fe(OH)2并能較長時間觀察其顏色組卷:1引用:3難度:0.5 -
4.下列離子方程式正確的是( )
A.向含Fe3+的CuSO4溶液中加入適量CuO:2Fe3++3CuO+3H2O=2Fe(OH)3+3Cu2+ B.向AgNO3溶液中加入過量氨水:Ag++NH3?H2O=AgOH↓+NH4+ C.Cu2O加入足量稀硝酸中:Cu2O+2H+=Cu+Cu2++H2O D.向甲酸溶液中加入足量Cu(OH)2濁液并加熱:2HCOOH+Cu(OH)2=Cu2++2HCOO-+2H2O 組卷:8引用:2難度:0.5 -
5.2016年IUPAC確認了四種新元素,其中一種為Mc,中文名為“鏌”。元素Mc可由反應:
Am+24395Ca→4820Mc+3288115n得到。下列有關說法正確的是( )10A.Mc (鏌)是長周期元素 B. Mc與287115Mc互為同素異形體288115C. Ca2+核內質子數為184820D. Am原子的核外電子數為14824395組卷:87引用:2難度:0.7 -
6.工業上用鋁土礦(主要成分Al2O3,含SiO2、Fe2O3等雜質)冶煉鋁的主要流程如圖:
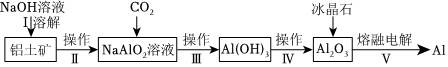
(注:SiO2堿溶時轉變為鋁硅酸鈉沉淀)
下列敘述錯誤的是( )A.操作Ⅰ增大NaOH溶液用量可提高Al2O3的浸取率 B.操作Ⅱ、Ⅲ均需用到分液漏斗,操作Ⅳ需用到蒸發皿 C.通入過量CO2的離子方程式為 +CO2+2H2O═Al(OH)3↓+AlO-2HCO-3D.加入的冰晶石目的是降低Al2O3的熔融溫度 組卷:4引用:2難度:0.7
二、非選擇題(每空2分,共52分)
-
19.某研究小組在實驗室以廢銅屑(主要成分是CuO,含有少量的Fe、Fe2O3)為原料制備堿式碳酸銅[Cu2(OH)2CO3],具體流程如圖:
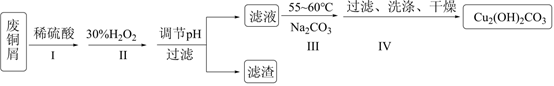
已知:Cu2(OH)2CO3為綠色固體,難溶于冷水和乙醇,水溫越高越易分解。
(1)為加快廢銅屑在稀硫酸中的溶解速率,可采取的措施為(任寫一種)。
(2)“操作Ⅱ”中Fe2+發生反應的離子方程式為。
(3)濾渣的成分為:。
(4)洗滌Cu2(OH)2CO3沉淀的操作為。
(5)“操作Ⅲ”中溫度選擇55~60℃的原因是;該步驟生成Cu2(OH)2CO3的同時產生CO2,請寫出該反應的化學方程式:。組卷:2引用:2難度:0.6 -
 20.1.某廢水中可能含有下列離子中的若干種:Fe3+、Al3+、Fe2+、Cu2+、Cl-、、CO2-3、NO-3、SO2-4.現進行如下實驗:SiO2-3
20.1.某廢水中可能含有下列離子中的若干種:Fe3+、Al3+、Fe2+、Cu2+、Cl-、、CO2-3、NO-3、SO2-4.現進行如下實驗:SiO2-3
Ⅰ.取少量溶液,加入KSCN溶液,無明顯變化
Ⅱ.另取溶液加入少量鹽酸,有無色氣體生成,該無色氣體遇空氣變成紅棕色
Ⅲ.向Ⅱ中所得溶液中加入BaCl2溶液,有白色沉淀生成
Ⅳ.向Ⅱ中所得溶液中加入過量濃氨水,僅有紅褪色沉淀生成,過濾,在所得溶液中加入鹽酸至酸性時,再加入氫氧化鈉溶液,有藍色沉淀生成
請回答下列問題:
(1)該廢水一定含有的離子是;
(2)實驗Ⅱ中加入鹽酸生成無色氣體的離子方程式是;
(3)過濾除去Ⅳ中的藍色沉淀,調整溶液的pH為10.7左右時,加入鋁粉,反應產生氨氣和氮氣的體積比為1:4,其離子方程式為Al++OH-NO-3+NH3+N2+H2O(未配平).若除去0.2AlO-2,消耗鋁molNO-3g.
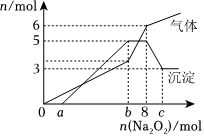
2.某混合液中,可能大量含有的離子如表:
為探究其成分,某同學將Na2O2逐漸加入到上述混合溶液中并微熱,產生沉淀和氣體的物質的量與加入Na2O2的物質的量的關系分別如圖所示:陽離子 H+、K+、Al3+、 、Mg2+NH+4陰離子 Cl-、Br-、OH-、 、CO2-3AlO-2
(1)該溶液中一定含有的陽離子是,其對應物質的量濃度之比為,溶液中一定不存在的陰離子是.
(2)請寫出沉淀減少的離子方程式.組卷:37引用:3難度:0.5


