蘇教版(2019)必修第二冊《專題6 化學反應與能量變化》2021年單元測試卷(3)
發布:2024/12/9 14:30:2
一、選擇題(共15小題,每小題2分,滿分30分)
-
1.已知碳酸鈣受熱分解為氧化鈣和二氧化碳是吸熱反應,下列說法錯誤的是( )
A.1mol CO2(g)和1mol CaO(s)的總能量大于1mol CaCO3(s)的能量 B.該反應的焓變大于零 C.該反應中有離子鍵斷裂也有共價鍵斷裂,化學鍵斷裂吸收能量,化學鍵生成放出能量 D.由該反應可推出凡是需要加熱才發生的反應均為吸熱反應 組卷:17引用:1難度:0.6 -
2.下列裝置中,能構成原電池的是( )
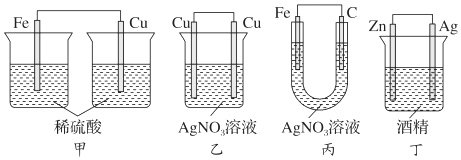
A.只有(甲) B.只有(乙) C.只有(丙) D.除(乙)均可以 組卷:242引用:24難度:0.9 -
3.將Al條插入6mol?L-1的鹽酸中,反應過程中產生H2速率的變化情況如圖1所示。下列說法錯誤的是( )
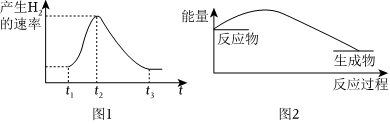
A.圖1中開始階段產生氣體速率較慢可能是因為Al條表面有氧化膜 B.圖1中t1~t2時間段內速率變化的主要原因是反應放熱,溶液溫度升高 C.圖1中影響t2~t3時間段內速率變化的主要因素是c(Cl-) D.圖2可以表示該反應過程的能量變化 組卷:66引用:3難度:0.5 -
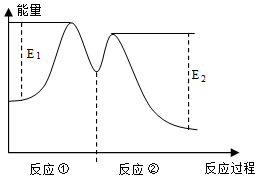 4.一定溫度下,向10mL 0.40mol/L H2O2溶液中加入少量FeCl3溶液(忽略整個過程中溶液體積的變化),不同時刻測得生成O2的體積(已折算為標準狀況下)
4.一定溫度下,向10mL 0.40mol/L H2O2溶液中加入少量FeCl3溶液(忽略整個過程中溶液體積的變化),不同時刻測得生成O2的體積(已折算為標準狀況下)
如表所示:
資料顯示。反應分兩步進行:t/min 0 2 4 6 V(O2)/mL 0 9.9 17.5 22.4
①2Fe3++H2O2═2Fe2++2H++O2;
②H2O+2Fe2++2H+═2H2O+2Fe3+。
反應過程中能量變化如圖所示,下列說法正確的是( )A.Fe2+的作用是增大過氧化氫的分解速率 B.反應①、②均是放熱反應 C.反應2H2O2(aq)═2 H2O (l)+O2(g)是吸熱反應 D.0~6 min內的平均反應速率v(H2O2)=3.33×10-2mol/(L?min) 組卷:50引用:8難度:0.5 -
5.NH3和純凈的O2在一定條件下發生反應:4NH3(g)+3O2(g)?2N2(g)+6H2O(g),現向一容積不變的2L密閉容器中充入4mol NH3和3mol O2,4min后,測得生成的H2O占混合氣體體積的40%,則下列表示此段時間內該反應的平均速率不正確的是( )
A.v(O2)=0.225mol?L-1?min-1 B.v(H2O)=0.375mol?L-1?min-1 C.v(N2)=0.125mol?L-1?min-1 D.v(NH3)=0.250mol?L-1?min-1 組卷:200引用:20難度:0.5 -
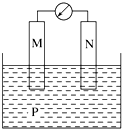 6.如圖所示裝置中觀察到電流計指針偏轉,M棒變粗,N棒變細,指針指向M,由此判斷下表中所列M、N、P物質,其中可以成立的組合是( )
6.如圖所示裝置中觀察到電流計指針偏轉,M棒變粗,N棒變細,指針指向M,由此判斷下表中所列M、N、P物質,其中可以成立的組合是( )M N P A 鋅 銅 稀硫酸溶液 B 銅 鐵 稀鹽酸溶液 C 銀 鋅 硝酸銀溶液 D 鋅 鐵 硝酸鐵溶液 A.A B.B C.C D.D 組卷:123引用:14難度:0.9 -
7.有a、b、c、d四個金屬電極,實驗裝置及部分實驗現象如表。由此判斷這四種金屬的活動性順序是( )
實驗裝置 部分實驗現象 實驗裝置 部分實驗現象 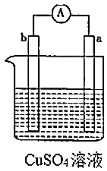
①a極質量減少,b極質量增加 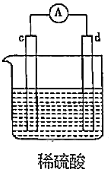
②d極溶解,c極有氣泡產生 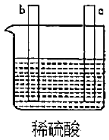
③b極有氣泡產生,c極無明顯變化 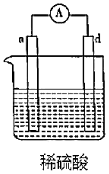
④電流從a極流向d極 A.a>b>c>d B.d>a>b>c C.b>c>d>a D.a>b>d>c 組卷:21引用:1難度:0.5
三、實驗題(共3小題,滿分26分)
-
22.某探究小組用酸性KMnO4溶液與H2C2O4溶液反應過程中溶液紫色消失快慢的方法,研究影響化學反應速率的因素。實驗條件作如下限定:所用酸性KMnO4溶液的濃度可選擇0.01mol/L、0.001mol/L,催化劑的用量可選擇0.5g、0g,實驗溫度可選擇298K、323K。每次實驗中酸性KMnO4溶液、H2C2O4溶液(0.1mol/L)的用量均為4mL。
(1)寫出反應的離子方程式:。
(2)請完成以下實驗設計表:完成ⅳ的實驗條件,并將實驗目的補充完整。
(3)該反應的催化劑選擇MnCl2還是MnSO4實驗編號 溫度/K 酸性KMnO4溶液的濃度/(mol/L) 催化劑的用量/g 實驗目的 ⅰ 298 0.01 0.5 a.實驗ⅰ和ⅱ探究酸性KMnO4溶液的濃度對該反應速率的影響;
b.實驗ⅰ和ⅲ探究對該反應速率的影響;
c.實驗ⅰ和ⅳ探究催化劑對該反應速率的影響ⅱ 298 0.001 0.5 ⅲ 323 0.01 0.5 ⅳ (填“MnCl2”或“MnSO4”)。簡述選擇的理由:。
(4)某同學對實驗ⅰ和ⅱ分別進行了3次實驗,測得以下數據(從混合振蕩均勻開始計時):
①實驗ⅱ中用酸性KMnO4溶液的濃度變化量來表示的化學反應速率為實驗編號 溶液褪色所需時間t/min 第1次 第2次 第3次 ⅰ 12.8 13.0 11.0 ⅱ 4.9 5.1 5.0 。(忽略混合前后溶液的體積變化)
②該同學分析上述數據后得出“當其他條件相同的情況下,酸性KMnO4溶液的濃度越小,所需要的時間就越短,亦即其反應速率越快”的結論,你認為是否正確?。(填“是”或“否”)組卷:5引用:1難度:0.6 -
23.Fenton法常用于處理含難降解有機物的工業廢水,通常是在調節好pH和 濃度的廢水中加入H2O2,所產生的羥基自由基能氧化降解污染物。現運用該方法降解有機污染物p—CP,探究有關因素對該降解反應速率的影響。
[實驗設計]控制p—CP的初始濃度相同,恒定實驗溫度在298K或313K(其余實驗條件見下表),設計如下對比試驗。
(1)請完成以下實驗設計表(表中不要留空格)。
[數據處理]實驗測得p—CP的濃度隨時間變化的關系如圖。實驗編號 實驗目的 T/K pH c/10-3mol?L-1 H2O Fe2+ (1) 為以下實驗作參照 298 3 6.0 0.30 (2) 探究溫度對降解反應速的影響率 (3) 298 10 6.0 0.30 
(2)請根據如圖實驗①曲線,計算降解反應在50~150s內的反應速率:(p—CP)=mol?L-1?s-1
[解釋與結論]
(3)實驗①、②表明溫度升高,降解反應速率增大。但溫度過高時反而導致降解反應速率減小,請從Fenton法所用試劑H2O2的角度分析原因:
(4)實驗③得出的結論是:pH值等于10時,
[思考與交流]
(5)實驗時需在不同時間從反應器中取樣,并使所取樣品中的反應立即停止下來。根據上圖中的信息,給出一種迅速停止反應的方法:。組卷:166引用:9難度:0.5


