2021-2022學年湖南省邵陽市新邵縣高二(上)期末化學試卷
發布:2024/11/15 1:30:2
一、選擇題(本題共10小題,每小題3分,共30分,每小題只有一個選項符合題目要求)
-
1.在標準狀況下,氣態分子斷開1mol化學鍵的焓稱為鍵焓.已知幾種化學鍵的鍵焓如下表所示:
下列說法正確的是( )化學鍵 C—C C═C C≡C C—H H—H Cl-Cl H—Cl 鍵焓(ΔH)/kJ?mol-1 347.7 615.0 812.0 413.4 436.0 242.7 431 A.CH2=CH2(g)+H2(g)→CH3CH3(g)ΔH=+123.5 kJ?mol-1 B.CH≡CH(g)+2H2(g)→CH3CH3(g)ΔH=-317.3 kJ?mol-1 C.穩定性:H—H鍵<H—Cl鍵<C—H鍵 D.由上表數據可計算乙烷與氯氣發生一氯代反應的焓變(ΔH) 組卷:40引用:4難度:0.9 -
2.下列由實驗得出的結論正確的是( )
選項 實驗 實驗結論或解釋 A 取2mL 0.1mol?L-1FeCl3溶液中滴加 0.1mol?L-1KI溶液,溶液5~6滴,充分反應后,再滴加幾滴0.01mol?L-1KSCN溶液,出現血紅色溶液。 Fe3+與I-所發生的反應屬于可逆反應 B 探究溫度對硫代硫酸鈉與硫酸反應速率的影響時,若先將兩種溶液混合并計時,再用水浴加熱至設定溫度 則測得的反應速率偏高 C 分別向裝有2 mL0.1mol?L-1H2C2O4溶液和2mL0.2mol?L-1H2C2O4溶液的兩支試管中加入4 mL0.01mol?L-1酸性KMnO4溶液,振蕩,后者溶液先褪色。 探究濃度對反應速率的影響 D 將石灰石與鹽酸反應產生的氣體直接通入水玻璃中,生成白色沉淀 非金屬性:C>Si A.A B.B C.C D.D 組卷:10引用:2難度:0.5 -
3.已知可逆反應:4NH3(g)+5O2(g)?4NO+6H2O(g).ΔH=-1025kJ?mol-1.若反應物起始物質的量相同,下列關于該反應的示意圖不正確的是( )
A. 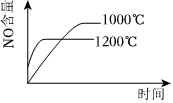
B. 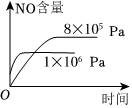
C. 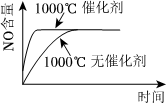
D. 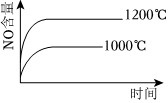 組卷:19引用:2難度:0.6
組卷:19引用:2難度:0.6 -
4.常溫下,下列各組離子一定能在指定溶液中大量共存的是( )
A.pH=1的溶液:Ba2+、Al3+、Cl-、SO42- B.滴加酚酞變紅的溶液:SO42-、Al3+、K+、Cl- C. =1×10-12的溶液中:K+、Na+、CO32-、NO3-c(H+)c(OH-)D.有NO3-存在的強酸性溶液:NH4+、Ba2+、Fe2+、Br- 組卷:11引用:5難度:0.7 -
5.下列敘述正確的是( )
A.鋼鐵在空氣中發生電化學腐蝕時,鐵作負極 B.電解飽和食鹽水制燒堿時,Fe作陽極,石墨作陰極 C.原電池工作時,陽離子移向電池的負極 D.電解氯化銅溶液時,陽極上產生的氣體質量和陰極上析出的銅的質量相等 組卷:10引用:2難度:0.6 -
6.室溫下進行下列實驗,根據實驗操作和現象所得到的結論正確的是( )
選項 實驗操作和現象 結論 A 用潔凈鉑絲蘸取某溶液在火焰上灼燒,火焰顯黃色 溶液中不含K+ B 向濃度均為0.05mol?L-1的NaI、NaCl混合溶液中滴加少量AgNO3溶液,有黃色沉淀生成 Ksp(AgI)>Ksp(AgCl) C 向3mLKI溶液中滴加幾滴溴水,振蕩,再滴加1mL淀粉溶液,溶液顯藍色 Br2的氧化性比I2的強 D 用pH試紙測得:CH3COONa溶液的pH約為9,NaNO2溶液的pH約為8 HNO2電離出H+的能力比CH3COOH的強 A.A B.B C.C D.D 組卷:14引用:3難度:0.7
三、非選擇題(本題包括4小題,共54分)
-
19.偏二甲肼(C2H8N2)、肼(N2H4)和四氧化二氮(N2O4)可作為運載火箭的推進劑.
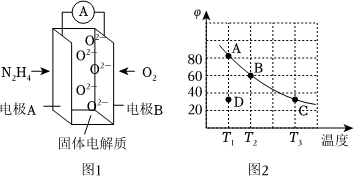
(1)已知:C2H8N2(l)+4O2(g)═N2(g)+4H2O(g)+2CO2(g)ΔH1
N2(g)+2O2(g)═2NO2(g)ΔH2
2NO2(g)?N2O4(l)ΔH3,
C2H8N2(l)和N2O4(l)反應生成N2(g)、CO2(g)和H2O(g)并放出大量熱,寫出該反應的熱化學方程式(ΔH用含ΔH1、ΔH2、ΔH3的代數式表示).該反應(填“是”或“不是”)自發反應,判斷的理由是.
(2)肼(N2H4)也可用于新型環保燃料電池中,燃料電池的工作原理示意圖如圖1所示,該燃料電池的負極反應式為.
(3)將4mol N2O4放入2L恒容密閉容器中發生反應N2O4(g)?2NO2(g),平衡體系中N2O4的體積分數(φ)隨溫度的變化如圖2所示.
①D點v(正)v(逆)(填“>”“=”或“<”).
②A、B、C三點中平衡常數K的值最大的是點.T2時,N2O4的平衡轉化率為;若達到平衡所需時間為5s,則此時間內N2O4的平均反應速率為.
③若其他條件不變,在T3原平衡基礎上,再加入一定量NO2,達到新平衡時,與原平衡相比,NO2的體積分數(填“增大”“不變”或“減小”).組卷:10引用:1難度:0.6 -
20.某科研人員以廢鎳催化劑(主要成分為NiO,另含Fe2O3、CaO、CuO、BaO)為原料回收鎳,工藝流程如圖。
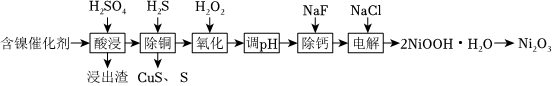
已知:常溫下,有關氫氧化物開始沉淀和沉淀完全的pH如表。
回答下列問題:氫氧化物 Fe(OH)3 Fe(OH)2 Ni(OH)2 開始沉淀的pH 1.5 6.5 7.7 沉淀完全的pH 3.7 9.7 9.2
(1)浸出渣主要成分為、。(填化學式)
(2)“除銅”時,Fe3+與H2S反應的離子方程式為。
(3)“氧化”的目的是將溶液中Fe2+氧化為Fe3+,溫度需控制在40~50℃之間,該步驟溫度不能太高的原因是。
(4)“調pH”時,pH的控制范圍為。
(5)“除鈣”后,若溶液中F-濃度為3×10-3mol?L-1,則=c(Ca2+)c(F-)。[已知常溫下,Ksp(CaF2)=2.7×10-11]
(6)在堿性條件下,電解產生2NiOOH?H2O的原理分兩步,其中第一步是Cl-在陽極被氧化為ClO-,則該步電極反應式為。組卷:277引用:9難度:0.5


