2020-2021學年山東省德州市高一(下)期末化學試卷
發(fā)布:2024/11/27 1:30:2
一、選擇題:本題共10小題,每小題2分,共20分。每小題只有一個選項符合題目要求。
-
1.下列敘述正確的是( )
A.葡萄酒中添加少量SO2,可以起到殺菌和抗氧化的作用 B.純堿能與酸反應調(diào)節(jié)面團的酸度,常用作膨松劑 C.酒精和ClO2泡騰片可殺滅新冠病毒,二者消毒原理相同 D.汽車尾氣中的PM2.5濃度比空氣中的少,不會污染空氣 組卷:3引用:2難度:0.7 -
2.下列化學用語正確的是( )
A.中子數(shù)為20的氯原子: Cl1720B.N2的電子式: 
C.乙烯結(jié)構(gòu)簡式:CH2CH2 D.乙醇的分子式:C2H6O 組卷:2引用:1難度:0.7 -
3.下列說法中正確的是( )
A.化學鍵只能存在于化合物中 B.只含共價鍵的物質(zhì)一定是共價化合物 C.非極性鍵只存在于單質(zhì)分子中 D.含有離子鍵的化合物一定是離子化合物 組卷:11引用:1難度:0.8 -
4.下列關(guān)于有機物的說法中,不正確的是( )
A.蔗糖可以水解生成葡萄糖與果糖 B.將碘化鉀溶液滴在土豆片上,可觀察到藍色 C.利用油脂在堿性條件下的水解,可以制肥皂 D.用飽和碳酸氫鈉溶液可以鑒別乙醇和乙酸 組卷:31引用:1難度:0.7 -
5.關(guān)于化學反應的限度的敘述正確的是( )
A.每個化學反應的限度都是固定不變的 B.可以通過改變反應條件來改變化學反應的限度 C.可以通過延長化學反應的時間來改變化學反應的限度 D.當一個化學反應在一定條件下達到限度時,反應即停止 組卷:29引用:2難度:0.8 -
6.設NA為阿伏加德羅常數(shù)的值,下列說法正確的是( )
A.7.8gNa2O2固體中含有的陰離子數(shù)為0.2NA B.1molCu與足量的S完全反應時轉(zhuǎn)移電子數(shù)目為2NA C.2gH218O 與D216O的混合物中所含的中子數(shù)和電子數(shù)均為NA D.足量乙烷與22.4L(標準狀況)Cl2發(fā)生取代反應,形成C-Cl鍵的數(shù)目為2NA 組卷:4引用:2難度:0.7
三、非選擇題:本題共5小題,共60分。
-
19.鈉及其化合物在生產(chǎn)生活中應用廣泛。
(1)某汽車安全氣囊的產(chǎn)氣藥劑主要含有NaN3。當汽車發(fā)生碰撞時,NaN3迅速分解產(chǎn)生N2和Na,同時放出大量的熱。N2使氣囊迅速膨脹,從而起到保護作用。藥劑中添加Fe2O3可處理產(chǎn)生的Na,該反應的化學方程式為。為了吸收產(chǎn)氣過程釋放的熱量,可在藥劑中添加(填字母)作冷卻劑。
a.SiO2
b.NH4NO3
c.NaHCO3
d.BaSO4
(2)高鐵酸鈉(Na2FeO4)是一種新型水處理劑。工業(yè)上常采用NaClO氧化法生產(chǎn),反應原理為:在堿性條件下,利用NaClO氧化Fe(OH)3制得Na2FeO4。Na2FeO4中Fe的化合價為,制備1molNa2FeO4需消耗NaClO的物質(zhì)的量為。Na2FeO4除了殺菌消毒還可凈水,其凈水原理為。
(3)氫化鈉(NaH)是重要的還原劑,與水反應可生成H2。某同學用圖示裝置,將鋅和鹽酸反應后的氣體經(jīng)濃硫酸干燥,排凈直型玻璃管內(nèi)的氣體,點燃C處的酒精燈,反應得到固體物質(zhì)即為純凈的NaH。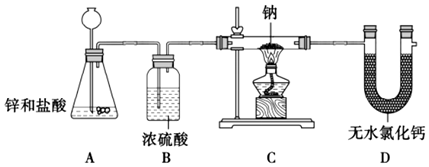
判斷該同學制備的氫化鈉可能含有的雜質(zhì)是(填化學式),提出你的改進方案:。組卷:12引用:1難度:0.7 -
20.將濃度均為0.01 mol/L 的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一定時間后溶液變?yōu)樗{色。該實驗是一種“碘鐘實驗”。某小組同學在室溫下對該“碘鐘實驗”的原理進行探究。
【資料】
該“碘鐘實驗”的總反應:H2O2 +2S2O32-+2H+═S4O62-+2H2O
反應分兩步進行:
反應A:H2O2 +2I-+2H+═I2+2H2O
反應B:……
(1)反應B的離子方程式是。對于總反應,I-的作用相當于。
(2)為證明反應A、B的存在,進行實驗Ⅰ。
a.向酸化的H2O2溶液中加入試劑X的水溶液,溶液變?yōu)樗{色。
b.再向得到的藍色溶液中加入Na2S2O3溶液,溶液的藍色褪去。
試劑X是。
試劑
(3)為探究溶液變藍快慢的影響因素,進行實驗Ⅱ、實驗Ⅲ。
(溶液濃度均為0.01 mol/L)
溶液從混合時的無色變?yōu)樗{色的時間:實驗Ⅱ是30 min、實驗Ⅲ是40 min。用量(ML)
序號H2O2
溶液H2SO4
溶液Na2S2O3
溶液KI溶液
(含淀粉)
H2O實驗Ⅱ 5 4 8 3 0 實驗Ⅲ 5 2 x y z
①實驗Ⅲ中,x、y、z所對應的數(shù)值分別是。
②對比實驗Ⅱ、實驗Ⅲ,可得出的實驗結(jié)論是。
(4)為探究其他因素對該“碘鐘實驗”的影響,進行實驗Ⅳ.(溶液濃度均為0.01 mol/L)
實驗過程中,溶液始終無明顯顏色變化。用量(mL)
號
試劑H2O2
溶液H2SO4
溶液Na2S2O3
溶液KI溶液(含淀粉)
H2O實驗Ⅳ 4 4 9 3 0
試結(jié)合該“碘鐘實驗”總反應方程式及反應A與反應B速率的相對快慢關(guān)系,解釋實驗Ⅳ未產(chǎn)生顏色變化的原因:。組卷:135引用:17難度:0.5


