2022年廣東省廣州市華南師大附中高考化學押題試卷(一)
發布:2024/4/20 14:35:0
一、選擇題:本題共16小題,共44分。第1~10小題,每小題2分;第11~16小題,每小題2分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.2021年10月13日,聯合國生物多樣性大會通過《昆明宣言》,宣言承諾最遲在2030年使生物多樣性走上恢復之路,進而實現“人與自然和諧共生”的愿景。下列做法不適宜推廣的是( )
A.減少塑料袋的使用 B.開發使用清潔能源 C.垃圾分類回收利用 D.禁止使用農藥化肥 組卷:56引用:4難度:0.6 -
2.下列化學用語或圖示表達不正確的是( )
A. 的電子式:NH+4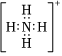
B.CO2的結構式:O═C═O C.甲苯的空間填充模型: 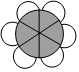
D.Ca2+的結構示意圖: 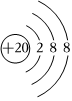 組卷:32引用:3難度:0.7
組卷:32引用:3難度:0.7 -
3.下列方程式與所給事實不相符的是( )
A.濃硝酸用棕色瓶保存:4HNO3 4NO2↑+O2↑+2H2O光照B.過量碳酸氫鈉與氫氧化鋇溶液反應:2HCO3-+Ba2++2OH-═BaCO3↓+CO32-+2H2O C.硫酸銨溶液顯酸性:NH4++H2O?NH3?H2O+H+ D.電解精煉銅的陽極反應:Cu2++2e-═Cu 組卷:57引用:6難度:0.7 -
4.下列說法正確的是( )
A.標準狀況下,5.6LCH4中所含C-H鍵的數目為6.02×1023 B.室溫下,1L0.1mol?L-1CH3COOH溶液中CH3COO-的數目為6.02×1022 C.質量相同的H2O和D2O(重水)所含的原子數相同 D.室溫下,pH=12的氨水中,OH-的物質的量為0.01mol 組卷:47引用:6難度:0.8 -
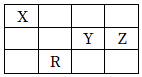 5.元素X、Y、Z和R在周期表中的位置如圖所示。R位于第四周期,X、Y、Z原子的最外層電子數之和為17。下列說法正確的是( )
5.元素X、Y、Z和R在周期表中的位置如圖所示。R位于第四周期,X、Y、Z原子的最外層電子數之和為17。下列說法正確的是( )A.X基態原子的核外電子排布式為2s22p2 B.電負性:R>Y C.0.033mol?L-1的H3RO4溶液的pH約等于1 D.還原性:Y2->Z- 組卷:66引用:2難度:0.5 -
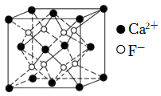 6.螢石是制作光學玻璃的原料之一其主要成分氟化鈣的晶胞結構如圖所示。下列說法正確的是( )
6.螢石是制作光學玻璃的原料之一其主要成分氟化鈣的晶胞結構如圖所示。下列說法正確的是( )A.氟化鈣的化學式為CaF B.每個晶胞中含有14個Ca2+ C.氟化鈣中只含有離子鍵 D.每個Ca2+周圍距離最近且等距的F-有4個 組卷:191引用:7難度:0.4
二、非選擇題:本題共4小題,共56分。
-
19.氨氮廢水會造成水體富營養化。可用沉淀法處理氨氮廢水并獲利緩釋肥料磷酸鎂銨(MgNH4PO4),過程如圖所示。
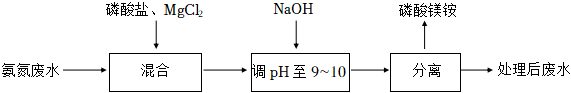
資料:
i.氧氮廢水中氮元素主要以NH4+形式存在;
ii.Mg3(PO4)2、MgNH4PO4,難溶于水;
iii.當c(Mg2+)和c(NH4+)為1mol?L-1時,生成Mg3(PO4)2沉淀所需的c(PO43-)約為1×10-12mol?L-1,生成MgNH4PO4沉淀所需的c(PO43-)約為1×10-13mol?L-1。
(1)檢驗溶液中NH4+的操作是。
(2)經處理后,分離磷酸鎂銨所用的方法是。
(3)磷酸鹽若選擇Na3PO4混合后會產生大量Mg3(PO4)2沉淀,反應的離子方程式為,氨氮去除率將(填“提高”“降低”或“不變”)。
(4)含磷微粒的物質的量分數與pH的關系如圖所示。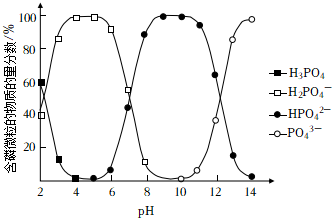
下列說法正確的是(填序號)。
a.Na2HPO4溶液呈酸性
b.Na3PO4和Na2HPO4溶液中,微粒的種類相同
c.等濃度的Na3PO4和Na2HPO4溶液中,[c(H3PO4)+c(H2PO4-)+c(HPO42-)+c(PO43-)]相等
(5)處理氨氮廢水時,磷酸鹽可選用Na2HPO4。
①pH在9~10之間,主要生成MgNH4PO4沉淀,反應的離子方程式為。
②pH過大會降低廢水中氨氮的去除率,可能的原因是。
③對于c(NH4+)較低的氨氮廢水,上述磷酸銨鎂沉淀法的處理效果不佳,且無法通過地加Na2HPO4和MgCl2的用量來改善,原因是。組卷:67引用:2難度:0.5 -
20.Cr(OH)3常用于顏料、陶瓷、橡膠等工業。實驗室模擬工業上以BaCrO4為原料制備Cr(OH)3的主要步驟如下。
(1)制備CrCl3。取一定質量的BaCrO4和對應量的水加入到如圖所示三頸瓶中,水浴加熱并攪拌,一段時間后同時加入過量濃鹽酸和無水乙醇充分反應,生成CrCl3并逸出CO2氣體。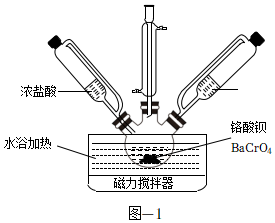
①上述反應的化學方程式為。
②在鹽酸與BaCrO4物料配比6:1、80℃條件下攪拌,反應30min。探究乙醇理論量倍數對鉻溶解率及還原率的影響如圖所示[鉻溶解率=×100%,鉻還原率=溶液中n(Cr總量)n(BaCrO4)×100%]。隨著乙醇理論量倍數的增加,鉻還原率逐漸增加、鉻溶解率幾乎不變,其原因可能是溶液中n[Cr(III)]n(BaCrO4)。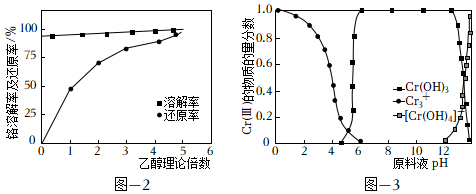
(2)制備Cr(OH)3。Cr(III)的存在形態的物質的量分數隨溶液pH的分布如圖所示。請補充完整由步驟(1)得到的CrCl3溶液制得Cr(OH)3的實驗方案:取步驟(1)得到的CrCl3溶液,,低溫烘干,得到Cr(OH)3晶體。實驗中須使用的試劑:2mol?L-1Ba(OH)2溶液、0.1mol?L-1AgNO溶液、0.1mol?L-1HNO3溶液、蒸餾水。
(3)測定Cr(OH)3樣品純度。準確稱取0.9000g樣品,溶于過量硫酸并配成250.0mL溶液。取25.00mL溶液,用足量(NH4)2S2O8溶液將Cr3+氧化為Cr2O72-,煮沸除去過量的(NH4)2S2O8,冷卻至室溫。再加入過量KI溶液,以淀粉溶液為指示劑,用0.1000mol?L-1Na2S2O3標準溶液滴定至終點,消耗Na2S2O3溶液24.00mL(已知反應:Cr2O72-+6I-+14H+=3I2+2Cr3++7H2O;I2+2S2O32-=S4O62-+2I-)。計算Cr(OH)3樣品的純度(寫出計算過程):。組卷:116引用:3難度:0.5


