2022年天津市濱海新區七所重點學校高考化學聯考試卷
發布:2024/4/20 14:35:0
一、選擇題(本題共12個小題,每小題3分,共36分。在每小題給出的四個選項中,只有一項是符合題目要求的。)
-
1.化學與生活生產社會可持續發展密切相關,下列說法錯誤的是( )
A.石墨晶體中存在范德華力,常用作潤滑劑 B.用聚氯乙烯代替木材,生產快餐盒,以減少木材的使用 C.免洗洗手液的有效成分中含有活性銀離子,能使蛋白質變性 D.水煤氣合成甲醇等含氧有機物的過程屬于煤的液化,實現了煤的綜合利用 組卷:24引用:1難度:0.6 -
2.下列應用不涉及物質氧化性或還原性的是( )
A.用葡萄糖制鏡或保溫瓶膽 B.NO2參與酸雨的形成 C.用Na2SiO3溶液制備木材防火劑 D.用浸泡過高錳酸鉀溶液的硅藻土保鮮水果 組卷:35引用:1難度:0.7 -
3.下列說法正確的是( )
A.乙醛的鍵線式 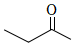
B.N2H4的電子式: 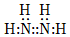
C.苯乙烯分子中所有原子可能在同一個平面上 D.硫酸鋇在濃度均為0.1mol/L的Na2SO4和Al2(SO4)3溶液中的溶解度相同 組卷:75引用:1難度:0.8 -
4.下列有關說法正確的是( )
A.鉛酸蓄電池充電時,PbSO4在兩電極上生成 B.制造中國“奮斗者”號載人潛水器的鈦合金比純金屬鈦的熔點低、強度大 C.常溫下,pH均為5的鹽酸與氯化銨溶液中,升溫后氫離子濃度仍相等 D.298K時,反應2Mg(s)+CO2(g)═C(s)+2MgO(s)能自發進行,則該反應的ΔH>0 組卷:54引用:1難度:0.7 -
5.下列離子方程式的書寫及評價均合理的是( )
選項 離子方程式 評價 A 將2molCl2通入含有1molFeI2的溶液中:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- 正確:Cl2過量,可將Fe2+、I-均氧化 B 向Fe(OH)3中加入氫碘酸溶液:Fe(OH)3+3H+═Fe3++3H2O 正確:酸與堿反應生成鹽和水 C 過量SO2通入NaClO溶液中:SO2+H2O+ClO-═HClO+ HSO-3正確:說明酸性H2SO3強于HClO D 已知酸性:H2CO3>HCN> ,則向NaCN溶液中通入少量的CO2時:CN-+CO2+H2O═HCN+HCO-3HCO-3正確:NaCN 和CO2的反應產物與對應酸性強弱有關 A.A B.B C.C D.D 組卷:66引用:1難度:0.6
二、非選擇題
-
15.氧釩(IV)堿式碳酸銨晶體的化學式 (NH4)5[(VO)6(CO3)4(OH)9]?10H2O,難溶于水,是制備熱敏材料VO2的原料。實驗室以V2O5為原料合成該晶體的流程如圖1:
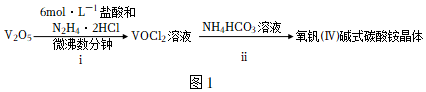
已知:+4價釩在弱酸性條件下具有還原性。
回答下列問題:
(1)步驟i中N2H4?2HCl屬于(填“正鹽”、“酸式鹽”或“堿式鹽”)。只用濃鹽酸與V2O5反應也能制備VOCl2溶液,但從環保角度分析,該反應不被推廣的主要原因是(用化學方程式表示)。
(2)步驟ii可在如圖2裝置中進行。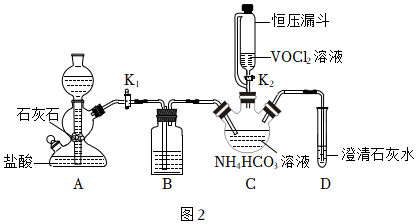
①B裝置盛裝的試劑是(填名稱)。
②實驗時,先關閉K2,打開K1,當觀察到(填實驗現象)時,再關閉K1,打開K2。
③反應結束后,得到紫紅色晶體,先用飽和NH4HCO3溶液洗滌3次,再用無水乙醇洗滌2次。用飽和NH4HCO3溶液洗滌除去的陰離子主要是(填離子符號)。
④檢驗用飽和NH4HCO3溶液洗滌沉淀是否干凈的操作是。
(3)稱量wg粗產品,用KMnO4溶液氧化,再除去多余的KMnO4(方法略),最后用1mol/L(NH4)2Fe(SO4)2標準溶液滴定至終點(滴定過程只發生反應+Fe2++2H+═VO2++Fe3++H2O),消耗標準溶液的體積為ymL。VO+2
①滴定時,可選用幾滴(填化學式)溶液作指示劑。
②粗產品中釩的質量分數為%(用含有 w、y的式子表示)。
③若實驗測得釩的質量分數偏大,則可能的原因是。
A.(NH4)2Fe(SO4)2標準溶液被氧化
B.滴定前平視讀數,滴定終點時仰視讀數
C.滴定前,滴定管內無氣泡,滴定結束后尖嘴有氣泡組卷:54引用:1難度:0.5 -
16.氮的氧化物是大氣污染物之一,研究氮氧化物的反應機理對緩解環境污染有重要意義,回答下列問題。
(1)碘蒸氣的存在能大幅度提高N2O的分解速率,反應歷程為:
第一步:I2(g)→2I(g) (快反應)
第二步:I(g)+N2O(g)→N2(g)+IO(g) (慢反應)
第三步:IO(g)+N2O(g)→N2(g)+O2(g)+I2(g) (快反應)
實驗表明:含碘時N2O分解速率方程v=k?c(N2O)?[c(I2)]0.5 (k 為速率常數)。下列表述正確的是。
A.升高溫度,第一步向右進行的程度變大
B.第二步的活化能比第三步小
C.IO為反應的催化劑
D.N2O分解反應的速率與是否含碘蒸氣有關
(2)為探究溫度及不同催化劑對反應2NO(g)+2CO(g)?N2(g)+2CO2(g) ΔH=-746.5kJ/mol的影響,分別在不同溫度、不同催化劑下,保持其它初始條件不變重復實驗,在相同時間內測得NO轉化率與溫度的關系如圖1所示。在催化劑乙作用下,圖中M點對應的速率(對應溫度400°C)v(正)v(逆)(填“>”、“<”或“=”),溫度升高后,兩種催化劑條件下NO轉化效率均明顯降低,原因可能是。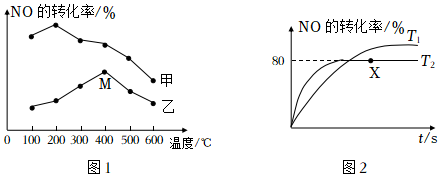
(3)實驗發現,NO易發生二聚反應2NO(g)?N2O2 (g)。向某恒容的容器中充入一定量的NO進行反應,測得溫度分別為T1和T2時NO的轉化率隨時間變化的結果如圖2所示。則T1T2(填“>”、“<”或“=”)。溫度為T2時,達到平衡時體系的總壓強為200kPa,X點對應的平衡常數Kp=kPa-1 (用分壓表示);提高NO平衡轉化率的條件為(寫出其中一點)。
(4)NH3催化還原NO是重要的煙氣脫硝技術,研究發現以Fe3+為主體催化劑時可能發生的反應過程如圖3,寫出脫硝過程總反應的化學方程式:。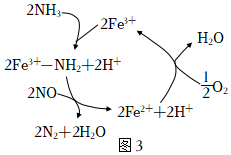 組卷:66引用:1難度:0.6
組卷:66引用:1難度:0.6


