2022年天津市七校聯考高考化學第二次質檢試卷
發布:2024/4/20 14:35:0
一、選擇題(共12小題,每小題3分,滿分36分)
-
1.化學與社會、生產、生活和科技都密切相關。下列有關說法正確的是( )
A.碳化硅俗稱金剛砂,可用作砂紙和砂輪的磨料 B.“天宮二號”使用的碳纖維,是一種新型有機高分子材料 C.汽車尾氣中含有的氮氧化物,是汽油不完全燃燒造成的 D.石油是混合物,可通過分餾得到汽油、煤油等純凈物 組卷:32引用:2難度:0.6 -
2.下列有關化學用語表示正確的是( )
A.ClO2的結構式:Cl-O-Cl B.CH4的球棍模型: 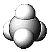
C.羥基(-OH)的電子式: 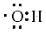
D.中子數為8的C原子: C148組卷:63引用:2難度:0.6 -
3.常溫下,在指定的溶液中一定能大量共存的離子組是( )
A.使pH試紙變藍的溶液:Al3+、Na+、SO42-、Cl- B. =1×10-12的溶液:K+、AlO2-、CO32-、Na+c(H+)c(OH-)C.加入苯酚顯紫色的溶液:Na+、NH4+、Cl-、I- D.c(SO32-)=0.1mol/L的溶液:K+、MnO4-、SO42-、H+ 組卷:102引用:3難度:0.7 -
4.下列實驗設計及其對應的離子方程式均正確的是( )
A.用FeCl3溶液腐蝕銅線路板:Cu+2Fe3+═Cu2++2Fe2+ B.Na2O2與H2O反應制備O2:Na2O2+H2O═2Na++2OH-+O2↑ C.將氯氣溶于水制備次氯酸:Cl2+H2O═2H++Cl-+ClO- D.用濃鹽酸酸化的KMnO4溶液與H2O2反應,證明H2O2具有還原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O 組卷:545引用:11難度:0.7 -
5.下列敘述正確的是( )
A.還原性:Cl->S2- B.第一電離能:N>O>C C.堿性:Sr(OH)2>CsOH D.熔點:晶體硅>碳化硅 組卷:64引用:3難度:0.8
二、解答題(共4小題,滿分64分)
-
15.高鐵酸鉀(K2FeO4)是一種新型的污水處理劑。
(1)K2FeO4的制備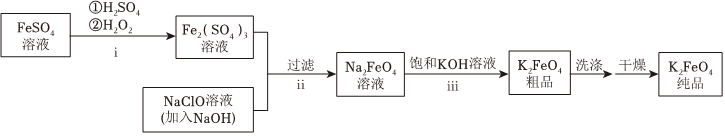
①i中反應的離子方程式是。
②將ii中反應的離子方程式補充完整:Fe3+ +OH-+ClO-═+FeO2-4+
③iii中反應說明溶解度:Na2FeO4K2FeO4(填“>”或“<”)。
(2)K2FeO4的性質
i.將K2FeO4固體溶于蒸餾水中,有少量無色氣泡產生,經檢驗為O2,液體有丁達爾效應。
ii.將K2FeO4固體溶于濃KOH溶液中,放置2小時無明顯變化。
iii.將K2FeO4固體溶于硫酸中,產生無色氣泡的速率明顯比i快。
①K2FeO4溶于蒸餾水的化學反應方程式是。
②K2FeO4的氧化性與溶液pH的關系是。
(3)K2FeO4的應用
K2FeO4可用于生活垃圾滲透液的脫氮(將含氮物質轉化為N2)處理。K2FeO4對生活垃圾滲透液的脫氮效果隨水體pH的變化結果如下: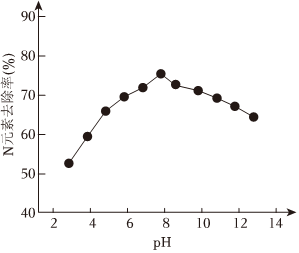
①K2FeO4脫氮的最佳pH是。
②根據圖推測,pH=4時生活垃圾滲透液中含氮物質主要以形式存在。
③pH大于8時,脫氮效果隨pH的升高而減弱,分析可能的原因:。組卷:184引用:7難度:0.5 -
16.Ⅰ.利用水煤氣合成二甲醚的反應如下:
①2H2(g)+CO(g)?CH3OH(g)ΔH=-90.8kJ/mol
②2CH3OH(g)?CH3OCH3(g)+H2O(g)ΔH=-23.5kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)ΔH=-41.3kJ/mol
總反應:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的ΔH=kJ/mol;一定條件下的密閉容器中,該總反應達到平衡,要提高CO的轉化率,可以采取的措施是(多選);
a.升溫加壓
b.加入催化劑
c.增加H2的濃度
d.增加CO的濃度
e.分離出二甲醚
Ⅱ.已知反應②2CH3OH(g)?CH3OCH3(g)+H2O(g)某溫度下的平衡常數為400。此溫度下,在密閉容器中加入CH3OH,反應到某時刻測得各組分的濃度如下:
①比較此時正逆反應速率的大小:v正物質 CH3OH CH3OCH3 H2O c/(mol?L-1) 0.44 0.6 0.6 v逆(填“>”“<”或“=”)。
②若加入CH3OH后,經10min反應達到平衡,此時c(CH3OH)=mol/L;該時間內反應速率v(CH3OH)=mol/(L?min)。
Ⅲ.汽車尾氣中NOx和CO的生成及轉化為:已知汽缸中生成NO的反應為N2(g)+O2(g)?2NO(g)△H>0。
①若1mol空氣含有0.8molN2和0.2molO2,1300°C時在密閉容器內反應達到平衡。測得NO為8×10-4mol。計算該溫度下的平衡常數K=;汽車啟動后,汽缸溫度越高,單位時間內NO排放量越大,原因是。
②汽車燃油不完全燃燒時產生CO,若設想按下列反應除去CO:2CO(g)=2C(s)+O2(g)。已知該反應的△H>0,判斷該設想能否實現并說明依據:。組卷:68引用:2難度:0.5


