2021-2022學年四川省成都市郫都區高一(上)期中化學試卷
發布:2024/11/10 6:30:2
一、選擇題(共48分)選擇題(每小題2分,共48分。每小題只有一個正確選項)
-
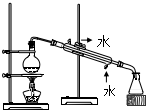
1.“安全無小事”,如圖所示實驗操作中,可能引起安全事故的是( )
A. 
取用液體B. 
點燃酒精燈C. 
取用固體D. 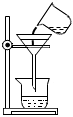
過濾組卷:12引用:1難度:0.6 -
2.如果家里的食用油不小心混入了部分水,利用所學的知識,最簡便的分離方法是( )
A. 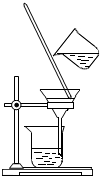
B. 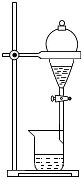
C. 
D. 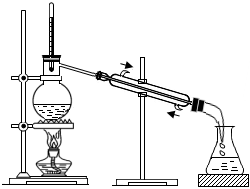 組卷:19引用:11難度:0.9
組卷:19引用:11難度:0.9 -
3.下列實驗操作中正確的是( )
A.蒸餾一段時間,發現沒有加入沸石,立即停止加熱,迅速補加,防止暴沸 B.過濾操作時,應將玻璃棒斜靠在三層濾紙上 C.蒸發操作時,應使混合物中的水分完全蒸干后,才能停止加熱 D.萃取操作時,可以選用CCl4或酒精作為萃取劑從碘水中萃取碘 組卷:5引用:2難度:0.8 -
4.下列實驗裝置能達到實驗目的的是( )
①分離乙醇和水 ②用自來水制取蒸餾水 ③從食鹽水中獲取氯化鈉 ④用排空氣法收集氯氣 
A.①② B.②③ C.③④ D.①④ 組卷:19引用:7難度:0.6 -
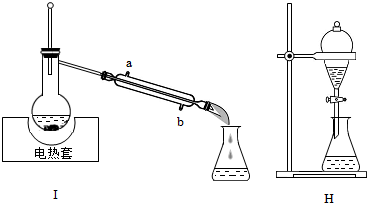 5.從苯、溴和水的混合物中分離出溴,所用裝置如圖所示,下列說法正確的是( )
5.從苯、溴和水的混合物中分離出溴,所用裝置如圖所示,下列說法正確的是( )A.用裝置Ⅰ加熱,收集全部餾出液,可以提高回收溴的物質的量和純度 B.裝置中a為進水口,b為出水口 C.用裝置Ⅱ萃取分液時,將分層的液體依次從下口放出 D.經裝置Ⅱ得到的粗產品干燥后,使用裝置I蒸餾,可得到更純的溴 組卷:24引用:1難度:0.7 -
6.下列關于氣體摩爾體積的幾種說法正確的是( )
A.22.4L任何氣體的物質的量均為1mol B.非標準狀況下,1mol任何氣體不可能占有22.4L體積 C.0.1mol H2、0.2mol O2、0.3mol N2和0.4mol CO2組成的混合氣體在標準狀況下的體積約為22.4L D.在同溫同壓下,相同體積的任何氣體單質所含分子數和原子數都相同 組卷:84引用:8難度:0.9 -
7.關于1mol/L的硫酸溶液,下列敘述中不正確的是( )
A.1L該溶液中含溶質98g B.從10mL該溶液中取出5mL后,剩余溶液的濃度為1mol/L C.該濃度的硫酸具有酸的通性,可與鋅反應制取氫氣 D.將含4.9g硫酸的濃硫酸加入盛有50mL蒸餾水的燒杯中,充分溶解后就可配得該濃度的硫酸溶液 組卷:21引用:1難度:0.8 -
8.同溫同壓下,用等質量的Cl2、SO2、O2、H2S四種氣體分別吹起四個氣球,其中是由Cl2吹起的是( )
A. 
B. 
C. 
D.  組卷:99引用:6難度:0.4
組卷:99引用:6難度:0.4 -
9.已知3.01×1023個X氣體分子的質量為14g,則X氣體的摩爾質量是( )
A.14 g B.28 C.28g/mol D.56g/mol 組卷:210引用:3難度:0.8
二、非選擇題(共52分)
-
27.“84”消毒液的主要成分NaClO,可以很快滅活(殺死)新冠病毒。
(1)某實驗用NaClO固體配制480mL2.0mol/LNaClO的消毒液,需要用托盤天平稱量NaClO的固體質量為g;如需配制100ml濃度為1.0mol/LNaClO的消毒液,需量取mL2.0mol/LNaClO的消毒液稀釋。
(2)配制時,一般可分為以下幾個步驟:
①稱量,
②計算,
③溶解,
④搖勻,
⑤移液,
⑥洗滌,
⑦定容,
⑧冷卻,
正確的操作順序為:(填序號)。
(3)在配制過程中,除需要燒杯、玻璃棒、量筒、天平外還必需的儀器有。
(4)下列操作可能使配制溶液濃度偏低的是(填字母)。
A.移液時,未洗滌燒杯內壁和玻璃棒
B.溶解后未經冷卻就移液
C.移液時,有少量液體濺出
D.定容時,俯視刻度線
E.容量瓶用蒸餾水洗凈后,沒烘干就直接使用
(5)“84”消毒液與潔廁靈(主要成分為HCl)混用會生成有毒的氯氣,反應方程式為NaClO+2HCl═NaCl+Cl2↑+H2O。該反應中還原劑是,還原產物是。寫出該反應的離子方程式:。組卷:10引用:3難度:0.6 -
28.試劑級NaCl可用海鹽(含泥沙、海藻、K+、Ca2+、Mg2+、Fe3+、
等雜質)為原料制備。制備流程簡圖如1所示:SO2-4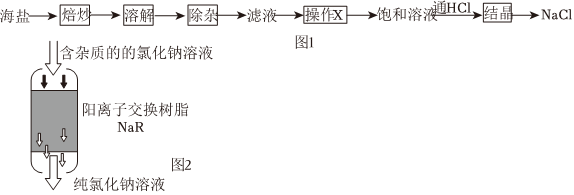
(1)從分類的角度,海鹽屬于物。
(2)根據除雜原理,在表中填寫除雜時依次添加的試劑及其預期沉淀的離子。
(3)除雜后,過濾得到濾液,這步操作有可能要重復進行,這是由于實驗步驟 試劑 預期沉淀的離子 步驟1 NaOH溶液 Mg2+和Fe3+ 步驟2 步驟3 。操作X為。
(4)在進行結晶操作時,看到蒸發皿中出現時停止加熱。在溶解、過濾、X、結晶這四步操作中,都要用到的一種玻璃儀器是。
(5)制得的試劑級NaCl晶體中一定還有的陽離子雜質為。稱取制得的試劑級NaCl晶體mg,加蒸餾水溶解,通過陽離子交換樹脂(用NaR表示),將溶液中的少量雜質陽離子全部轉化為鈉離子(如圖2),反應的離子方程式為。收集純氯化鈉溶液蒸發結晶,得到固體ng,則制得試劑級NaCl晶體中雜質陽離子的物質的量為(用含m、n的代數式表示)。組卷:3引用:2難度:0.7


