2022-2023學年湖北省問津聯(lián)合體高二(上)質(zhì)檢化學試卷(10月份)
發(fā)布:2024/6/4 8:0:5
一、選擇題(本題包括15小題,每小題3分,共45分。每小題只有一個選項符合題意)
-
1.下列說法正確的是( )
A.常溫下,若反應A(s)+B(g)═C(g)+D(g)不能自發(fā)進行,則該反應的△H>0 B.應該投入大量資金研究2CO(g)═2C(s)+O2(g)△H>0該過程發(fā)生的條件,以解決含碳燃料不充分燃燒引起的環(huán)境問題 C.熵增的反應都是自發(fā)的,自發(fā)反應的現(xiàn)象一定非常明顯 D.已知C(s)+CO2(g)═2CO(g)△H>0,該反應吸熱,一定不能自發(fā)進行 組卷:39引用:2難度:0.8 -
2.下列關于化學反應速率的說法正確的是( )
①恒溫時,增大壓強,化學反應速率一定加快
②其他條件不變,溫度越高,化學反應速率越快
③使用催化劑可改變反應速率,從而改變該反應過程中吸收或放出的熱量
④3mol?L-1?s-1的反應速率一定比1mol?L-1?s-1的反應速率大
⑤有氣體參加的化學反應,若增大壓強(即縮小反應容器的體積),可增加單位體積內(nèi)活化分子數(shù),從而使反應速率增大
⑥增大反應物濃度,可增大活化分子的百分數(shù),從而使單位時間有效碰撞次數(shù)增多A.②⑥ B.②⑤ C.①②③⑤ D.①②④⑤ 組卷:229引用:17難度:0.9 -
3.下列有關說法正確的是( )
A.已知HI(g)? H2(g)+12I2(s)△H=-26.5kJ?mol-1,由此可知1mol HI氣體在密閉容器中充分分解后可以放出26.5kJ的熱量12B.甲烷燃燒熱的數(shù)值為890.3kJ?mol-1,則甲烷燃燒的熱化學方程式可表示為:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ?mol-1 C.已知2C(s)+2O2(g)═2CO2(g)△H1,2C(s)+O2(g)═2CO(g)△H2,則△H1<△H2 D.含20.0g NaOH的稀溶液與稀鹽酸完全中和,放出28.7kJ的熱量,則稀醋酸和稀NaOH溶液反應的熱化學方程式為:NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.4kJ?mol-1 組卷:13引用:3難度:0.7 -
4.在一個不傳熱的固定容積的密閉容器中,可逆反應mA(g)+nB(g)→pC(g)+qD(g),當m、n、p、q為任意整數(shù)時,下列說法一定能說明反應已達到平衡的是( )
①體系的溫度不再改變
②各組分的濃度相等
③各組分的質(zhì)量分數(shù)不再改變
④反應速率v(A):v(B)=m:n
⑤n?v正(A)=m?v逆(B)
⑥體系氣體的平均相對分子質(zhì)量不再改變A.③⑤⑥ B.①③⑤ C.①②⑤ D.②⑤⑥ 組卷:7引用:4難度:0.5 -
5.在其他條件不變時,只改變某一條件,化學反應aA(g)+bB(g)?cC(g)的平衡的變化圖象如圖(圖中p表示壓強,T表示溫度,n表示物質(zhì)的量,α表示平衡轉(zhuǎn)化率),據(jù)此分析下列說法正確的是( )
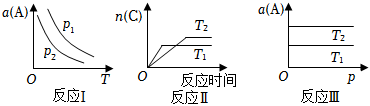
A.在圖象反應Ⅰ中,說明升高溫度,K值增大 B.在圖象反應Ⅱ中,說明該正反應為吸熱反應 C.在圖象反應Ⅲ中,若T1>T2,則該反應一定不能自發(fā)進行 D.在圖象反應Ⅰ中,若p2>p1,則有a+b<c 組卷:47引用:6難度:0.6 -
6.下列能用來描述可逆反應2A(g)+B(g)?2C(g)ΔH>0的圖象是( )
A. 
B. 
C. 
D.  組卷:50引用:7難度:0.5
組卷:50引用:7難度:0.5
二、非選擇題(共分55)
-
18.在10L的密閉容器中,進行如下化學反應:CO2(g)+H2(g)?CO(g)+H2O(g)
其化學平衡常數(shù)K與溫度t的關系如下表:
請回答:t(℃) 700 800 830 1000 1200 K 0.6 0.9 1.0 1.7 2.6
(1)該反應為(填“吸熱”或“放熱”)反應。
(2)該反應的化學平衡常數(shù)表達式為K=。保持溫度和體積不變,充入一定量的CO2,則平衡常數(shù)。(填“增大”、“減小”或“不變”)
(3)下列措施可以提高H2的轉(zhuǎn)化率的是(填選項序號)。
a.選擇適當?shù)拇呋瘎?br />b.增大壓強
c.及時分離H2O(g)
d.升高溫度
(4)某溫度下,c(CO2)=2mol/L,c(H2)=3mol/L,開始反應,達到平衡時CO2轉(zhuǎn)化率為60%,則平衡常數(shù)K=。
(5)與(4)相同的溫度下,某時刻測得c(CO2)=0.5mol/L,c(H2)=1.5mol/L,c(CO)=0.5mol/L、c(H2O)=0.5mol/L,則此時反應是否達到平衡狀態(tài)(填“是”或“否”)。此時,v(正)v(逆)(填“>”、“<”或“=”)。
(6)該反應的反應速率 (v) 隨時間 (t) 變化的關系如圖所示,若t2、t4時刻只改變一個條件,下列說法正確的是(填選項序號)。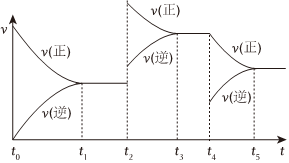
a.在t1-t2時,可依據(jù)容器內(nèi)氣體的壓強保持不變判斷反應已達到平衡狀態(tài)
b.在t2時,采取的措施可以是升高溫度
c.在t4時,采取的措施可以是增加CO2的濃度。
d.在t5時,容器內(nèi)CO的體積分數(shù)是整個過程中的最大值組卷:162引用:4難度:0.6 -
19.用CO2轉(zhuǎn)化為乙醇可實現(xiàn)碳循環(huán),近年來,隨著全球變暖及能源枯竭的加劇,由CO2制乙醇又再次成為各國的研究熱點。
Ⅰ.(1)CO2轉(zhuǎn)化為乙醇的一種途徑如下:
2CO2+2H2O(1)═C2H4(g)+3O2(g)ΔH1=+1411.0kJ?mol-1
C2H4(g)+H2O(l)?C2H5OH(l)ΔH2=-44.2kJ?mol-1
則2CO2(g)+3H2O(1)?C2H5OH(1)+3O2(g)ΔH=kJ?mol-1。
Ⅱ.已知CO2催化加氫制乙醇原理為2CO2(g)+6H2(g)?C2H5OH(g)+3H2O(g),回答下列問題:
(2)在恒溫恒容的密閉容器中,對CO2催化加氫制乙醇反應體系說法錯誤的。(填序號)
A.增大原料氣中的比例,有利于提高CO2的轉(zhuǎn)化率n(CO2)n(H2)
B.若混合氣體的密度保持不變,說明反應體系已達平衡
C.體系達平衡后,若壓縮容器容積,則反應平衡正向移動
(3)在均為2L的恒容密閉容器a和b中分別投入2molCO2和6molH2,在不同溫度下進行CO2加氫制乙醇的反應,各容器中乙醇的物質(zhì)的量與時間的關系如圖所示: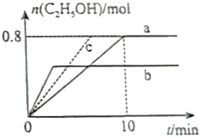
①容器a中0~10min氫氣的平均反應速率v(H2)=;
②若容器a、b中的反應溫度分別為T1、T2,則判斷ΔH0(填“>”或“<);
③若容器a中改變條件時,反應情況會由曲線a變?yōu)榍€c,則改變的單一條件可是(填序號);
A.加入更高效的催化劑
B.升溫
C.增大壓強
D.分離出乙醇
④T1溫度下反應達平衡時,容器a中氣體總壓強為4MPa,則T1時該反應的平衡常數(shù)Kp=(用平衡分壓代替平衡濃度計算,氣體的分壓=氣體總壓強×氣體的物質(zhì)的量分數(shù))。
(4)雖然由CO2催化加氫制乙醇目前還無法實現(xiàn)產(chǎn)業(yè)化,但該方法具有很多優(yōu)點、具有廣闊的綜合利用前景,試說明原因(任寫一個原因):。組卷:8引用:1難度:0.5


