2022-2023學年山西大學附中高二(上)月考化學試卷(10月份)
發布:2024/12/2 3:0:2
一、選擇題(每小題3分,共60分)
-
1.下面是四位同學在學習“化學反應的速率和化學平衡”一章后,聯系工業生產實際所發表的觀點,你認為不正確的是( )
A.化學反應速率理論可指導怎樣提高原料的平衡轉化率 B.化學有效碰撞理論可用來解釋改變外界條件反應速率的影響 C.化學平衡理論可指導怎樣使用有限原料多出產品 D.研究化學反應進行的方向可指導判斷反應在某個方向發生的可能性 組卷:4引用:1難度:0.5 -
2.下列有關化學反應自發性的說法中不正確的是( )
A.SiO2(s)+2C(s)═Si(s)+2CO(g)只能在高溫下自發進行,則該反應的ΔH>0 B.X2Y2(s)═X2(g)+Y2(g)ΔH<0,該反應在任意溫度下都可自發進行 C.BaSO4(s)+4C(s)═BaS(s)+4CO(g)在室溫下不能自發進行,說明該反應的ΔH<0 D.常溫下,2NO(g)+O2(g)═2NO2(g)能夠自發進行,則該反應的ΔH<0 組卷:32引用:1難度:0.7 -
3.下列說法正確的是( )
A.H2O(g)→H2O(1)→H2O(s),熵依次增加 B.FeCl3(aq)+3KSCN(aq)?Fe(SCN)3(aq)+3KCl(aq)反應達平衡之后,加入KCl固體,平衡將逆向移動 C.某可逆反應,若反應物總鍵能大于生成物總鍵能,則升高溫度不利于提高反應物的轉化率 D.對于有氣體參與的反應,其他條件不變,增大壓強反應速率加快,與活化分子的百分數無關 組卷:6引用:1難度:0.5 -
4.用一定濃度的NaOH溶液與稀鹽酸進行中和反應反應熱的測定實驗時,測得生成1mol液態水時的ΔH>-57.3kJ?mol-1,產生這種偏差的原因不可能是( )
A.實驗用NaOH溶液的濃度過大 B.實驗時攪拌速度慢 C.分2~3次把NaOH溶液倒入盛有稀鹽酸的小燒杯中 D.用量取完稀鹽酸的量筒直接量取氫氧化鈉溶液 組卷:19引用:1難度:0.7 -
5.N2(g)+3H2(g)?2NH3(g)ΔH<0,合成氨時既要提高H2的平衡轉化率,又要加快反應速率,可采取的辦法是( )
①加壓
②升溫
③及時從平衡混合氣中分離出NH3
④補充N2
⑤使用催化劑A.①②④ B.②④⑤ C.①④ D.①③④ 組卷:28引用:1難度:0.5 -
6.已知:298K時,相關物質的相對能量如下表所示:
下列說法不正確的是( )物質 H2(g) O2(g) C(s) CO(g) CO2(g) H2O(g) H2O(l) 相對能量/(kJ/mol) 0 0 0 -110 -393 -242 -286 A.1molH2完全燃燒生成H2O(l)放出的熱量為286kJ B.CO2(g)+H2(g)═CO(g)+H2O(g)ΔH=+41kJ/mol C.已知2C(s)+2O2(g)═2CO2(g)ΔH1,2C(s)+O2(g)═2CO(g)ΔH2,則ΔH1<ΔH2 D.將碳先與水蒸氣作用轉化成水煤氣再燃燒,與直接燃燒等質量的碳,反應后都恢復至室溫,兩個過程的熱效應是一樣的 組卷:10引用:1難度:0.7 -
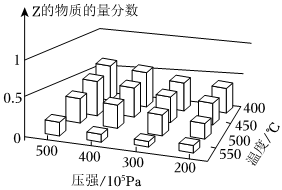 7.為探究外界條件對反應:mA(g)+nB(g)?cZ(g)ΔH的影響,以A和B的物質的量之比為m:n開始反應,通過實驗得到不同條件下反應達到平衡時Z的物質的量分數,實驗結果如圖所示。下列判斷正確的是( )
7.為探究外界條件對反應:mA(g)+nB(g)?cZ(g)ΔH的影響,以A和B的物質的量之比為m:n開始反應,通過實驗得到不同條件下反應達到平衡時Z的物質的量分數,實驗結果如圖所示。下列判斷正確的是( )A.ΔH>0 B.m+n<c C.升高溫度,υ正、υ逆都增大,平衡常數減小 D.恒溫恒壓時,向已達平衡的體系中加入少量Z(g),再次達到平衡后Z的物質的量分數增大 組卷:39引用:9難度:0.5
二、非選擇題(共40分)
-
22.研究+6價鉻鹽不同條件下微粒存在形式及氧化性,某小組同學進行如圖實驗:
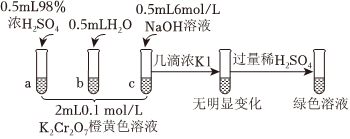
已知:①+6價鉻鹽在一定條件下可被還原為Cr3+,Cr3+在水溶液中為綠色:②微熱K2Cr2O7溶液,黃色加深。
(1)K2Cr2O7溶液中存在的轉化反應是(用離子方程式表示);b試管中加水后平衡(填“正向”、“不”或“逆向”)移動,c(Cr2O2-7)c(CrO2-4)(填“增大”、“減小”或“不變”)。
(2)對比試管c和b,推測試管c的現象是。對比試管a和b,a中溶液橙色加深。甲認為溫度也會影響平衡的移動,橙色加深不一定是c(H+)增大影響的結果;乙認為橙色加深一定是c(H+)增大對平衡的影響。你認為是否需要再設計實驗證明c(H+)對平衡的影響,并說明理由:。
(3)分析試管c繼續滴加KI溶液和過量稀H2SO4的實驗現象,說明+6價鉻鹽氧化性Cr2O72-CrO42-(填“大于”、“小于”或“不確定”);此過程中氧化還原反應的離子方程式為。組卷:7引用:2難度:0.5 -
23.CO2的綜合利用有利于減少空氣中CO2的含量,實現“碳達峰”、“碳中和”的目標。
已知:①C3H8(g)?C3H6(g)+H2(g)ΔH1=+123.8kJ?mol-1 Kp1=9.0
②3CO2(g)+9H2(g)?C3H6(g)+6H2O(g)ΔH2=-250.2kJ?mol-1 Kp2=3.0×102
③CO2(g)+H2(g)?CO(g)+H2O(g)ΔH3=+41.2kJ?mol-1
④CO2(g)+3H2(g)?CH3OH(g)ΔH4=-49kJ?mol-1
Ⅰ.CO2與C3H8的耦合反應體系中發生反應①②③。
(1)反應①在(填“高溫”或“低溫”)下能自發進行。CO2與C3H8耦合反應在In/HZSM-5催化劑作用下的微觀過程如圖,寫出該過程的熱化學方程式。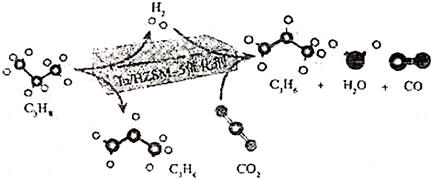
(2)為提高丙烷與CO2耦合過程中C3H6(g)的單位時間內產率,可采取的措施有(填序號)。
a.適當提高溫度
b.增大H2O(g)的濃度
c.增大體系的壓強
d.改善催化劑的性能
(3)CO2與C3H8耦合反應時發生另一反應9C3H8(g)+3CO2(g)?10C3H6(g)+6H2O(g),則該反應的平衡常數lgKp=(lg3=0.5)。
Ⅱ.CO2催化加氫制甲醇的體系發生反應③④。
(4)不同條件下,相同的時間段內CH3OH的選擇性和產率隨溫度的變化如圖。(CH3OH的選擇性=×100%)CH3OH的物質的量反應的CO2的物質的量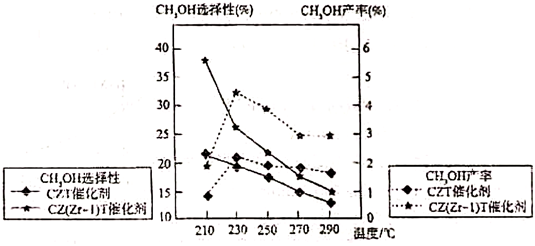
①由圖可知,合成甲醇的適宜條件為(填標號)。
A.CZT催化劑
B.CZ(Zr-1)T催化劑
C.230℃
D.290℃
②在230℃以上,升高溫度,CO2的平衡轉化率增大,但甲醇的產率降低,原因是。組卷:9引用:1難度:0.4


