2021-2022學年福建省福州三中高一(下)期末化學試卷
發布:2024/11/30 6:30:2
一、單選題
-
1.2022年6月5日,“神舟十四號”載人飛船成功對接于天和核心艙徑向端口,3名航天員順利進入天和核心艙。下列有關說法錯誤的是( )
A.鈦合金具有耐腐蝕和耐低溫等性能,可應用于航空航天領域 B.航天器的操縱桿采用的碳纖維屬于新型無機非金屬材料 C.火箭的整流罩前錐段材料--聚甲基丙烯酰亞胺屬于有機高分子材料 D.航天器使用的太陽能電池陣和鋰離子電池組工作時,均可將化學能轉化成電能 組卷:25引用:3難度:0.6 -
2.“端午節”是我國傳統節日之一,節日活動有吃粽子、賽龍舟及喝雄黃酒等。制作粽子的主要原料有糯米、粽葉,還有蛋黃、豬肉等餡料。下列有關說法正確的是( )
A.糯米也是釀酒原料,釀酒加入的“酒曲”起催化作用 B.賽龍舟時,揮舞的龍旗是用滌綸制作,滌綸屬于天然纖維 C.蛋黃、豬肉富含油脂和蛋白質,油脂和蛋白質均屬于高分子化合物 D.糯米的主要成分是淀粉,粽葉的主要成分是纖維素,淀粉和纖維素互為同分異構體 組卷:95引用:5難度:0.8 -
3.在氯化鐵、氯化銅和鹽酸混合溶液中加入鐵粉,待反應結束,所剩余的固體濾出后能被磁鐵吸引,則反應后溶液中存在較多的陽離子是( )
A.Cu2+ B.Fe3+ C.Fe2+ D.H+ 組卷:148引用:11難度:0.7 -
4.廈門中學生助手在一定條件下,向密閉容器中充入18O2和SO2發生反應2SO2+O2
2SO3。下列說法正確的是( )催化劑△A.反應一段時間后,含有18O的分子只有O2和SO3 B.達到平衡后,反應生成的SO3不再分解 C.反應混合物中SO2、O2的物質的量之比為2:1時,說明反應已達平衡狀態 D.當SO3的消耗速率等于O2消耗速率的2倍時,說明反應已達平衡狀態 組卷:103引用:3難度:0.8 -
5.在給定條件下,下列選項中所示的物質間轉化均能一步實現的是( )
A.Fe FeCl2Cl2點燃Fe(OH)2NaOH(aq)B.S SO3足量氧氣點燃H2SO4H2OC.N2 NO2O2HNO3H2OD.CaCl2(aq) CaCO3NH3CO2CaSiO3SiO2點燃組卷:23引用:1難度:0.7 -
 6.用如圖所示的裝置完成相應實驗(夾持儀器略去),a、b、c中分別盛有試劑1、2、3,能達到實驗目的的是( )
6.用如圖所示的裝置完成相應實驗(夾持儀器略去),a、b、c中分別盛有試劑1、2、3,能達到實驗目的的是( )選項 試劑1 試劑2 試劑3 實驗目的 A 濃氨水 CaO 濃硫酸 制取干燥的NH3 B 濃硫酸 Cu片 濃硫酸 制取干燥的SO2 C 濃鹽酸 KMnO4 飽和NaCl溶液 制取Cl2并除去HCl D 濃硝酸 Fe片 H2O 制取干燥的NO2 A.A B.B C.C D.D 組卷:11引用:3難度:0.5 -
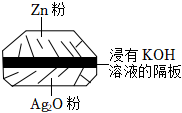 7.新冠肺炎最明顯的癥狀就是出現發熱,體溫槍能快速檢測人體體溫。該體溫槍所用的電池為一種銀鋅電池(如圖所示),該電池的總反應式為:Zn+Ag2O+H2O═Zn(OH)2+2Ag。下列關于該電池的說法正確的是( )
7.新冠肺炎最明顯的癥狀就是出現發熱,體溫槍能快速檢測人體體溫。該體溫槍所用的電池為一種銀鋅電池(如圖所示),該電池的總反應式為:Zn+Ag2O+H2O═Zn(OH)2+2Ag。下列關于該電池的說法正確的是( )A.Ag2O電極作正極,發生氧化反應 B.該電池放電時溶液中的K+向Zn電極移動 C.電池工作時,電流從Ag2O電極經過隔板流向Zn電極 D.該電池的負極反應為:Zn-2e-+2OH-═Zn(OH)2 組卷:58引用:7難度:0.7
二、第II卷(非選擇題)
-
20.氨基甲酸銨(H2NCOONH4)是一種重要的化工原料,可用作化學肥料、滅火劑洗滌劑等。某化學興趣小組用以下裝置制取氨基甲酸銨。

已知:①制取氨基甲酸銨反應為:2NH3(g)+CO2(g)?H2NCOONH4(s)△H<0。
②氨基甲酸銨易分解、易吸水,溶于水后生成碳酸氫銨和一水合氨。
回答下列問題:
(1)檢查裝置1氣密性的操作是。
(2)裝置6中的試劑是,導管a出口直接與尾氣處理裝置連接,該尾氣處理裝置中的試劑是。
(4)三頸燒瓶需用冰水浴冷卻,其目的是。
(5)CCl4液體中產生較多晶體懸浮物時,即停止反應。停止反應的操作是,從三頸燒瓶中分離出粗產品的操作是。
(6)因部分變質而混有碳酸氫銨的氨基甲酸銨樣品1.173g,用足量石灰水充分反應后,使碳元素全部轉化為碳酸鈣,經過濾、洗滌、干燥后稱量,測得質量為1.500g。寫出石灰水與氨基甲酸銨反應轉化為碳酸鈣的反應方程式。樣品中氨基甲酸銨的質量分數是。(計算結果保留小數點后兩位)[Mr(H2NCOONH4)=78、Mr(NH4HCO3)=79]組卷:13引用:2難度:0.5 -
21.丙烯是一種重要的化工原料,以丙烯為原料衍生出部分化工產品的反應如圖(部分反應條件已略去)。請回答下列問題:

(1)A的結構簡式為,E中官能團的名稱為。
(2)反應①②③④中,屬于取代反應的是(填序號)。
(3)聚丙烯(英文縮寫:PP)具有機械強度高、耐化學腐蝕等特性,可用于制作薄膜、管道等,寫出聚丙烯的結構簡式:。
(4)寫出下列反應的化學方程式:
①C→D:。
②B+E→F:。
(5)寫出C所有同分異構體的結構簡式。
(6)1個丙烯分子中最多個原子在同一平面上。組卷:25引用:2難度:0.5


