2022-2023學年天津一中高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每小題有1個正確答案)
-
1.氫燃料電池汽車由于具備五大優勢:零排放、零污染、無噪音、補充燃料快、續航能力強,而備受關注。某氫燃料電池汽車的結構如圖所示:
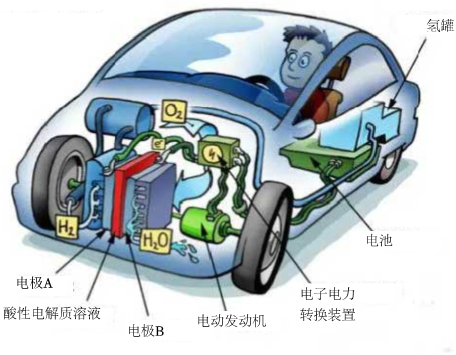
下列說法錯誤的是( )A.電極A、B采用多孔電極材料的優點是能增大反應物接觸面積 B.“電池”能將燃料電池產生的多余電能暫時儲存起來 C.電極B的電極反應式為O2+4e-═2O2- D.質子通過電解質溶液向電極B遷移 組卷:51引用:5難度:0.7 -
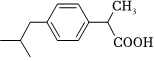 2.布洛芬是臨床上廣泛應用的一種非甾體抗炎藥,被廣泛應用于緩解關節炎、神經炎、各種軟組織風濕性疼痛及具有解熱作用,其結構如圖所示,下列說法正確的是( )
2.布洛芬是臨床上廣泛應用的一種非甾體抗炎藥,被廣泛應用于緩解關節炎、神經炎、各種軟組織風濕性疼痛及具有解熱作用,其結構如圖所示,下列說法正確的是( )A.該分子中有2個手性碳原子 B.該分子中含有4個π鍵 C.該物質易溶于水 D.該分子中碳原子的雜化軌道類型有2種 組卷:41引用:1難度:0.6 -
3.下列有關化學用語的表述正確的是( )
A.基態Se原子的價層電子排布式為:3d104s24p4 B.鎂原子由1s22s22p63s13pl→1s22s22p63s2時,會吸收能量 C.基態鈹原子最外層電子的電子云輪廓圖為: 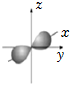
D.基態碳原子的核外電子軌道表示式為: 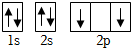 組卷:200引用:4難度:0.7
組卷:200引用:4難度:0.7 -
4.根據價層電子對互斥模型,判斷下列分子或者離子的空間構型是三角錐形的是( )
A.H3O+ B.HCHO C.BCl3 D.O3 組卷:149引用:3難度:0.6 -
5.下列說法中,正確的是( )
A.S區全部是金屬元素 B.第四周期元素中,未成對電子數最多的元素位于第ⅥB族 C.第一電離能的大小可以作為判斷元素金屬性強弱的依據 D.電負性大于1.8的一定是非金屬,小于1.8的一定是金屬 組卷:84引用:1難度:0.6 -
6.下列說法正確的是( )
A.元素周期表每一周期元素原子的最外層電子排布均是從ns1過渡到ns2np6 B.高溫時CuO比Cu2O穩定 C. 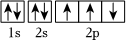 此圖錯誤,違背了泡利原理
此圖錯誤,違背了泡利原理D.Fe3+的最外層電子排布式為3s23p63d5 組卷:104引用:1難度:0.7 -
7.下列說法正確的是( )
A.甲醇、甲醛都存在分子之間氫鍵 B.第一電離能在Al和P之間的元素有2種 C.分子空間構型V形,中心原子可能發生sp2雜化或sp3雜化 D.氣體單質中,一定有σ鍵,可能有π鍵 組卷:76引用:1難度:0.6 -
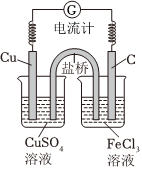 8.有關電化學知識的描述正確的是( )
8.有關電化學知識的描述正確的是( )A.反應Cu+H2SO4═CuSO4+H2↑可設計成原電池實現 B.利用Cu+2FeCl3═CuCl2+2FeCl2,可設計如圖所示原電池裝置,鹽橋內K+向FeCl3溶液移動 C.氯化鋁是一種電解質,可用于電解法熔融態氯化鋁制金屬鋁 D.在鐵制品上鍍銀時,鐵制品與電源正極相連 組卷:231引用:2難度:0.4
二、填空題
-
23.Ⅰ.近年來,我國航天事業發展迅猛,這與材料技術的進步密切相關。如新型儲氫材料、陶瓷基復合材料氮化硼(BN)、太陽能電池材料砷化鎵(GaAs)等,請按要求回答問題:
(1)基態砷原子簡化的核外電子排布式為,其電子占據的最高能層符號是,占據最高能級的所在的原子軌道為形。與As位于同一周期,且未成對電子數也相同的元素有(寫元素符號)。
(2)硼氫化鈉(NaBH4)是研究最廣泛的儲氫材料之一,它可以與水反應緩慢產生氫氣:NaBH4+2H2O═NaBO2+4H2↑(反應前后B元素的化合價不變)。上述方程式中所涉及的元素的電負性由大到小的順序為;的空間構型為BH-4。
(3)乙二胺(H2NCH2CH2NH2)是一種有機物,分子中N原子、C原子的雜化方式分別為、。乙二胺能與Cu2+、Mg2+等金屬離子形成穩定環狀離子,其原因是;其中與乙二胺形成的化合物穩定性相對較高的是(填Cu2+或Mg2+)。
Ⅱ.金屬材料Fe、Cu、Zn等在工業生產和日常生活中有廣泛的應用。
(4)黃銅是銅和鋅組成的合金,銅、鋅兩種元素位于元素周期表的區,Cu、Zn的第二電離能(I2):>。
(5)下列狀態的銅,電離最外層一個電子所需能量最大的是。
A.[Ar]3d104s1
B.[Ar]3d10
C.[Ar]3d94s1
D.[Ar]3d104p1
(6)Fe3+可與H2O、SCN-、F-等配體形成配位數為6的配離子,如[Fe(H2O)6]3+、[Fe(SCN)6]3-、[FeF6]3-。某同學按如下步驟完成實驗: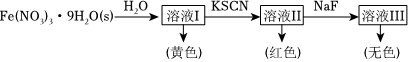
已知:向Co2+的溶液中加入KSCN溶液生成藍色的[Co(SCN)4]2-配離子;Co2+不能與F-形成配離子。
①1mol[Fe(H2O)6]3+中含有molσ鍵;[Fe(H2O)6]3+為淺紫色,但溶液Ⅰ卻呈黃色,其原因是,為了能觀察到溶液Ⅰ中[Fe(H2O)6]3+的淺紫色,可采取的方法是。
②檢驗FeCl3溶液中含有Co2+的實驗方法是:取FeCl3溶液于試管中,。組卷:59引用:2難度:0.6 -
24.電化學在現代生活、生產和科學技術的發展中發揮著越來越重要的作用。
(1)Na2FeO4是制造高鐵電池的重要原料,同時也是一種新型的高效凈水劑。在工業上通常利用如圖裝置生產Na2FeO4。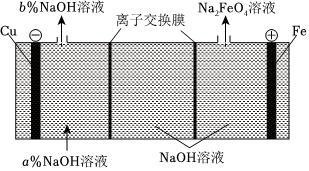
①陽極的電極反應式為。
②右側的離子交換膜為(填“陰”或“陽”)離子交換膜,陰極區a%b%(填“>”“═”或“<”)。
③陰極產生的氣體為。
(2)SO2和NOx是主要大氣污染物,如圖是同時吸收SO2和NOx的示意圖。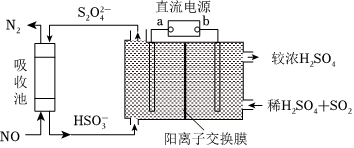
①b是直流電源的極。
②已知電解池的陰極室中溶液的pH在4~7之間,陰極的電極反應為。
③當NOx均為NO時,吸收池中發生反應的氧化劑與還原劑的物質的量之比為。
(3)某原電池裝置如圖所示,電池總反應為2Ag+Cl2═2AgCl。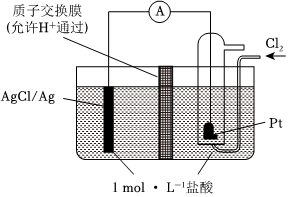
①當電路中轉移amole-時,交換膜左側溶液中約減少mol離子。
交換膜右側溶液中c(HCl)(填“>”“<”或“═”)1mol?L-1(忽略溶液體積變化)。
②若質子交換膜換成陰離子交換膜,其他不變。若有11.2L氯氣(標準狀況)參與反應,則必有mol離子通過交換膜向側遷移。(填“左”、“右”)組卷:86引用:1難度:0.5


