2022-2023學年山東省濟南市歷城二中高二(上)期末化學試卷(線上)
發布:2024/4/20 14:35:0
一、選擇題(本題共15小題,每小題2分,共30分。每小題只有一個選項符合題目要求。)
-
1.化學與生產生活密切相關,下列說法正確的是( )
A.泡沫滅火器的成分是蘇打和硫酸鋁溶液 B.采用催化轉換技術能提高汽車尾氣中有害氣體的平衡轉化率 C.粗鎳精煉時,粗鎳作陽極 D.漂白粉和明礬都常用于自來水的處理,二者的作用原理是相同的 組卷:8引用:2難度:0.6 -
2.下列描述中正確的是( )
A.CS2是空間構型為V形的極性分子 B.PCl3、CO32-和SO32-的中心原子均為sp3雜化 C.在基態14C原子中,核外存在2對自旋相反的電子,其核外電子有4種運動狀態 D.雙原子或多原子形成的氣體單質中,一定有σ鍵,可能有π鍵 組卷:94引用:1難度:0.6 -
3.下列與化學反應能量變化相關的敘述中錯誤的是( )
A.放熱反應的反應速率總是大于吸熱反應的反應速率 B.物質發生化學變化一定伴隨能量的變化 C.同溫同壓下,H2(g)+Cl2(g)═2HCl(g)在光照和點燃條件下的ΔH相同 D.水凝結成冰的過程中,ΔH<0、ΔS<0 組卷:34引用:4難度:0.6 -
4.[Cu(NH3)4]SO4?H2O是一種重要的染料及合成農藥中間體.下列說法錯誤的是( )
A.Cu元素位于周期表d區 B.基態O原子核外電子占據的最高能級的電子云輪廓圖為啞鈴形 C.NH3分子中的鍵角小于SO42-離子中的鍵角 D.基態S原子的未成對電子數為2 組卷:44引用:3難度:0.8 -
5.某同學利用如圖所示裝置探究金屬的腐蝕與防護條件。下列不合理的是( )
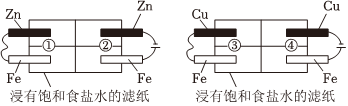
A.①區Zn電極的電極反應式為Zn-2e-═Zn2+,Fe電極附近滴加K3[Fe(CN)6]溶液未出現藍色,Fe被保護 B.②區Zn電極的電極反應式為2H2O+2e-═H2↑+2OH-,Fe電極附近滴加K3[Fe(CN)6]溶液出現藍色,Fe被腐蝕 C.③區Cu電極上產生氣泡,Fe電極附近滴加K3Fe(CN)6溶液后出現藍色,Fe被腐蝕 D.④區Cu電極附近滴加酚酞后變成紅色,Fe電極附近滴加K3[Fe(CN)6]溶液出現藍色,Fe被腐蝕 組卷:54引用:2難度:0.5 -
6.表中實驗操作、現象與結論對應關系均正確的( )
選項 實驗操作 實驗現象 結論 A 等體積pH═2的兩種酸HX和HY分別與足量的鋅反應 HX溶液中放出的H2多 HX的酸性比HY強 B 向濃度均為0.1mol/L的NaCl和NaI的混合溶液中滴加少量0.1mol/L的AgNO3溶液 產生黃色沉淀 Ksp(AgCl)>Ksp(AgI) C 在KSCN與FeCl3的混合液中再加入KCl固體 溶液顏色變淺 增大生成物濃度,平衡逆向移動 D 用廣泛pH試紙測定1mol/LNaHSO3溶液的酸堿性 測定pH═3.2 NaHSO3溶液呈酸性,證明HSO3-在水中的電離程度大于水解程度 A.A B.B C.C D.D 組卷:42引用:3難度:0.5 -
7.下列操作或裝置能達到實驗目的的是( )
選項 A B C D 操作或裝置 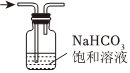
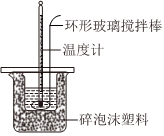
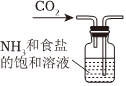

實驗目的 除去Cl2中混有的HCl 測定中和熱 制取碳酸氫鈉 中和滴定 A.A B.B C.C D.D 組卷:11引用:4難度:0.5 -
8.如圖是一種新型的光化學電源,當光照射N型半導體時,通入O2和H2S即產生穩定的電流并獲得H2O2 (H2AQ和AQ是兩種有機物)。下列說法正確的是( )
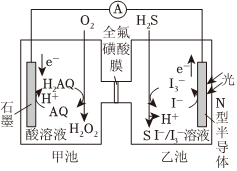
A.甲池中的石墨電極是電池的負極 B.H+通過全氟磺酸膜從甲池進入乙池 C.甲池中石墨電極上發生的電極反應為AQ+2H+-2e-=H2AQ D.總反應為 H2S+O2 H2O2+S↓光照組卷:45引用:2難度:0.7
三、非選擇題(本題共4小題,共50分)
-
23.碳酸鈉俗稱純堿,是一種重要的化工原料。以碳酸氫銨和氯化鈉為原料制備碳酸鈉,并測定產品中少量碳酸氫鈉的含量,過程如下:
步驟Ⅰ.Na2CO3的制備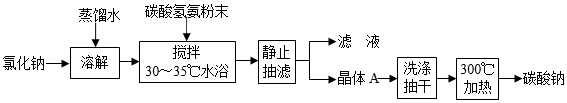
步驟Ⅱ.產品中NaHCO3含量測定
①稱取產品2.500g,用蒸餾水溶解,定容于250mL容量瓶中;
②移取25.00mL上述溶液于錐形瓶,加入2滴指示劑M,用0.1000mol?L-1鹽酸標準溶液滴定,溶液由紅色變至近無色(第一滴定終點),消耗鹽酸V1mL;
③在上述錐形瓶中再加入2滴指示劑N,繼續用0.1000mol?L-1鹽酸標準溶液滴定至終點(第二滴定終點),又消耗鹽酸V2mL;
④平行測定三次,V1平均值為22.45,V2平均值為23.51。
已知:(ⅰ)當溫度超過35℃時,NH4HCO3開始分解。
(ⅱ)相關鹽在不同溫度下的溶解度表(g/100g H2O)
回答下列問題:溫度/℃ 0 10 20 30 40 50 60 NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 NH4HCO3 11.9 15.8 21.0 27.0 NaHCO3 6.9 8.2 9.6 11.1 12.7 14.5 16.4 NH4Cl 29.4 33.3 37.2 41.4 45.8 50.4 55.2
(1)步驟Ⅰ中晶體A的化學式為,晶體A能夠析出的原因是;
(2)步驟Ⅰ中“300℃加熱”所選用的儀器是(填標號);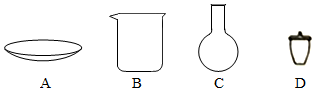
(3)指示劑N為,描述第二滴定終點前后顏色變化;
(4)產品中NaHCO3的質量分數為(保留三位有效數字);
(5)第一滴定終點時,某同學俯視讀數,其他操作均正確,則NaHCO3質量分數的計算結果(填“偏大”“偏小”或“無影響”)。組卷:517引用:8難度:0.5 -
24.大連化學物理研究所開發的DMTO技術曾獲得國家科學技術發明一等獎。該技術以煤為原料,經過煤→CO、H2→CH3OH→C2H4、C3H6等一系列變化可獲得重要的化工產品乙烯和丙烯。回答下列問題:
(1)煤氣化包含一系列化學反應,熱化學方程式如下:
①C(s)+H2O(g)?CO(g)+H2(g)△H1=+131kJ?mol-1
②CO(g)+H2O(g)?CO2(g)+H2(g)△H2=akJ?mol-1
③C(s)+CO2(g)=2CO(g)△H=+172kJ?mol-1,
則a=。
(2)已知某密閉容器中存在可逆反應:2CH3OH(g)?C2H4(g)+2H2O(g)△H,測得其他條件相同時,CH3OH的平衡轉化率隨著溫度(T)、壓強(p)的變化如圖1所示,平衡常數K與溫度T關系如圖2所示。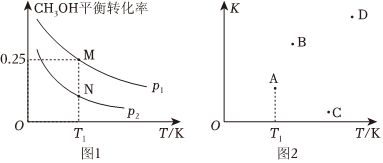
①該反應的△H(填“>”或“<”,下同)0,N點v(CH3OH)正M點v(CH3OH)逆。
②T1后升高溫度,則B、C、D三點中能正確表示該反應的平衡常數K隨著溫度T改變而變化的點是(填字母)。
(3)在一定溫度和適當催化劑存在下,將1molCO、2molH2通入恒容密閉容器中,使其發生反應CO(g)+2H2(g)?CH3OH(g)△H=-91kJ?mol-1,測得開始時容器內總壓為3×105Pa,反應經2min達到平衡且平衡時體系壓強減小,則該溫度下的平衡常數Kp=13Pa-2(Kp為分壓表示的平衡常數,分壓=總壓×物質的量分數)。組卷:32引用:1難度:0.5


