2023-2024學年北京市高三(上)入學定位化學試卷
發布:2024/8/17 5:0:1
一、選擇題:每題3分,共42分。在每題列出的四個選項中,選出最符合題目要求的一項。
-
1.下列材料的主要成分屬于有機化合物的是( )
A.北京冬奧工作人員服裝的發熱材料——石墨烯 B.長征五號的整流罩前錐段材料——聚甲基丙烯酰亞胺 C.港珠澳大橋錨具材料——特殊工藝的低碳鋼 D.我國自主研發的5G芯片的材料——硅 組卷:50引用:3難度:0.9 -
2.下列有關物質的性質與用途的敘述中,對應關系正確的是( )
A.明礬易水解,可用作凈水劑 B.NH3易溶于水,可用作制冷劑 C.SO2具有還原性,可用來漂白紙漿 D.濃硫酸具有脫水性,可用作干燥劑 組卷:6引用:1難度:0.7 -
3.下列說法正確的是( )
A.利用銀鏡反應可以區分葡萄糖和麥芽糖 B.油脂在堿性條件下可水解為甘油和高級脂肪酸 C.蛋白質遇飽和硫酸鈉溶液變性 D.核苷酸聚合成DNA是縮聚反應 組卷:68引用:3難度:0.7 -
4.用化學用語表示NH3+HCl═NH4Cl中的相關微粒,其中正確的是( )
A.中子數為8的氮原子為 87NB.由H和Cl形成HCl的過程為 
C.NH3的結構式為 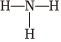
D.Cl-的結構示意圖為  組卷:58引用:5難度:0.8
組卷:58引用:5難度:0.8 -
5.稀溶液中,單位體積內溶質的分子或離子數目越多,該溶液的沸點越高。下列濃度均為0.01mol/L的溶液的沸點由高到低依次是( )
①蔗糖溶液
②K2SO4溶液
③NaCl溶液
④醋酸溶液A.②③④① B.②④③① C.③④②① D.②③① 組卷:30引用:1難度:0.7 -
6.下列反應的原理用離子方程式表示正確的是( )
A.室溫下,測得氯化銨溶液pH<7: +2H2O═NH3?H2O+H3O+NH+4B.用氫氧化鈉和鋁粉做管道疏通劑:2Al+2OH-+2H2O═2 +3H2↑AlO-2C.用碳酸氫鈉溶液檢驗水楊酸中的羧基: 
D.用高錳酸鉀標準溶液滴定草酸(H2C2O4,二元弱酸):2 +16H++5C2MnO-4═2Mn2++10CO2↑+8H2OO2-4組卷:10引用:1難度:0.7
二、非選擇題:本部分共5題,共58分。
-
18.軟錳礦在生產中有廣泛的應用。

(1)過程Ⅰ:酸浸
①用稀H2SO4溶液處理軟錳礦后,溶液中含有Fe3+,礦粉顆粒表面附著有黃色固體硫。上述過程中的主要反應為(將方程式補充完整):2FeS2+MnO2+=++4S+。
②硫附著在礦粉顆粒表面不利于酸浸進行,加入H2O2可以提高錳元素的浸出率。
結合化學方程式說明H2O2的作用原理:(寫出兩條)
i;
ii。
(2)過程Ⅱ:
①使用過量MnCO3固體可以去除酸浸后濾液中的Fe3+。選用MnCO3的理由是。
②制備Mn3O4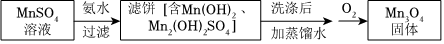
如圖表示通入O2時pH隨時間的變化: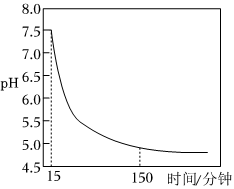
0~15分鐘,pH幾乎不變;15~150分鐘,pH明顯降低。結合方程式解釋原因:。組卷:8引用:1難度:0.5 -
19.探究pH對FeSO4溶液的配制和保存的影響。
Ⅰ.FeSO4溶液的配制
將0.28g(1×10-3mol)FeSO4?7H2O分別溶于10mL蒸餾水或10mL稀硫酸,現象如表:
(1)用離子方程式表示①中溶液顯酸性的主要原因編號 溶劑 溶液性狀 ① 蒸餾水 淺黃色澄清溶液 pH=3.8;滴加1mol/LKSCN溶液無明顯變化 ② 0.01mol/LH2SO4 無色澄清溶液 pH=1.8;滴加1mol/LKSCN溶液微微變紅 ③ 2mol/LH2SO4 無色澄清溶液 滴加1mol/LKSCN溶液微微變紅 。
(2)甲同學認為①溶液中一定有+3價鐵。他用激光筆照射“溶液”,觀察到光路;向含有KSCN的①溶液中滴入試劑a,溶液變紅,說明其推斷正確。試劑a是。
Ⅱ.FeSO4溶液的保存
將實驗Ⅰ中配制的三份溶液分別在空氣中放置24小時后,記錄如表。
(3)①中的渾濁主要是FeOOH,用離子方程式表示其生成過程編號 溶液性狀 ① 橙色渾濁 用H2SO4酸化后,濁液變澄清,再滴加1mol/LKSCN溶液后變深紅 ② 無色溶液 滴加1mol/L的KSCN溶液后顯淺紅色 ③ 無色溶液 滴加1mol/L的KSCN溶液后顯紅色,顏色比②略深 。
(4)該實驗的初步結論:保存FeSO4溶液的最佳pH是。
(5)進一步探究pH對FeSO4變質影響的原因。用如圖所示裝置完成實驗(滴加試劑時溶液體積和導電性變化可忽略)。向右池持續穩定通入氧氣,待電流計示數穩定后: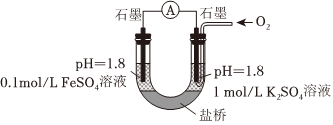
i.向左池滴加濃硫酸至c(H2SO4)接近2mol/L,電流沒有明顯變化;
ii.向右池滴加等量濃硫酸,電流明顯增大。
已知:電流增大表明化學反應速率加快,在該實驗條件下與物質的氧化性(還原性)增強有關。
a.結合電極反應式分析ii中電流增大的原因。
b.依據實驗i和ii推斷:③比②中FeSO4更易變質的原因是。
c.按上述原理進行實驗,證實①中FeSO4更易變質的主要原因是Fe2+的還原性增強,氧化速率加快,而與氧氣性質變化關系不大。實驗方案及預期現象是:向右池持續穩定通入氧氣,待電流計示數穩定后,。組卷:10引用:1難度:0.5


