2021-2022學年天津市部分區高三(上)期中化學試卷
發布:2024/4/20 14:35:0
一.本卷共12題,每題只有一個正確選項,每題3分,共36分
-
1.實驗室中下列做法錯誤的是( )
A.濃硝酸可保存在棕色試劑瓶中,并放置在陰涼處 B.用濃硫酸干燥二氧化硫 C.用酒精燈直接加熱蒸發皿 D.用二氧化碳滅火器撲滅金屬鉀的燃燒 組卷:14引用:1難度:0.8 -
2.北宋沈括《夢溪筆談》中記載:“信州鉛山有苦泉,流以為澗。挹其水熬之則成膽礬,烹膽礬則成銅。熬膽礬鐵釜,久之亦化為銅”。下列敘述錯誤的是( )
A.膽礬的化學式為CuSO4 B.膽礬晶體不導電,膽礬屬于電解質 C.“熬之則成膽礬”是濃縮結晶過程 D.“熬膽礬鐵釜,久之亦化為銅”是發生了置換反應 組卷:49引用:3難度:0.7 -
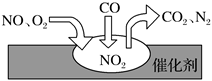 3.在汽車尾氣凈化裝置里,氣體在催化劑表面吸附與解 吸作用的過程如圖所示.下列說法錯誤的是( )
3.在汽車尾氣凈化裝置里,氣體在催化劑表面吸附與解 吸作用的過程如圖所示.下列說法錯誤的是( )A.NO2是該過程的中間產物 B.NO和O2必須在催化劑表面才能反應 C.汽車尾氣的主要污染成分包括CO和NO D.催化轉化總反應為:2NO+O2+4CO 4CO2+N2催化劑組卷:21引用:4難度:0.9 -
4.為了使魚苗順利地長途運輸,必須滿足3個條件:①需要保持適量的氧氣;②使魚苗呼出的二氧化碳及時排除;③防止細菌大量繁殖。已知下列4種物質加入水中都可以起到供氧殺菌的作用,在長距離儲運魚苗的水中,你覺得最好加入的藥劑是( )
A.Na2O2 B.CaO2 C.Cl2 D.H2O2 組卷:139引用:3難度:0.4 -
5.鉈(Tl)是某超導材料的組成元素之一,與鋁同族,位于第6周期.Tl3+與Ag在酸性介質中發生反應:Tl3++2Ag=Tl++2Ag+.下列推斷正確的是( )
A.Tl+的最外層有1個電子 B.Tl3+的氧化性比Al3+強 C.Tl 能形成+3價和+1價的化合物 D.Tl+的還原性比Ag強 組卷:14引用:2難度:0.5 -
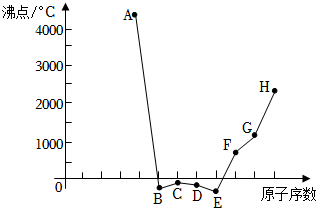 6.短周期內連續八種元素單質的沸點與原子序數的關系如圖,下列說法正確的是( )
6.短周期內連續八種元素單質的沸點與原子序數的關系如圖,下列說法正確的是( )A.上述元素中,A的最高價氧化物對應的水化物酸性最強 B.E元素原子最外層滿足8電子穩定結構 C.工業上可通過電解H的熔融氯化物的方法制備H的單質 D.F的簡單離子與C、D的簡單離子構成的化合物都是鹽 組卷:32引用:2難度:0.5
二.第Ⅱ卷非選擇題本卷共4題,共64分
-
17.已知:氧化性:IO3->Fe3+>I2;還原性:S2O32->I-.3I2+6OH-═IO3-+5I-+3H2O;KI+I2═KI3。
(1)某學習小組對加碘鹽進行如下實驗:取一定量某加碘鹽(可能含有KIO3、KI、Mg2+、Fe3+),用適量蒸餾水溶解,并加稀鹽酸酸化,將所得溶液分為3份。第一份試液中滴加KSCN溶液后顯紅色;第二份試液中加足量KI固體,溶液顯淡黃色,用CCl4萃取,下層溶液顯紫紅色;第三份試液中加入適量KIO3固體后,滴加淀粉試劑,溶液不變色。
①加KSCN溶液顯紅色,該紅色物質是(化學式)。
②該碘鹽中加入的含碘元素化合物是(化學式)。
③紫紅色物質為碘,寫出I2的電子式。
(2)由于空氣中氧氣的作用,KI作為加碘劑容易引起碘的損失。寫出潮濕環境下KI與氧氣反應的化學方程式:。
(3)將I2溶于KI溶液,在低溫條件下,可制得KI3?H2O。某同學認為該物質不適合作為食鹽加碘劑,說明理由:。
(4)為了提高加碘鹽(添加KI)的穩定性,可加穩定劑減少碘的損失。下列物質有可能作為穩定劑的是(填序號)。
a.Na2S2O3
b.NaNO2
C.Na2CO3組卷:29引用:1難度:0.6 -
18.完成關于錳元素的問題。
(1)已知:①MnO4-+e-→MnO42-(綠色,溶液pH=12)
②MnO4-+8H++5e-→Mn2++4H2O(無色,溶液pH=0)
錳有多種化合價,如+7、+6、+4、+2價等,在中性溶液里高錳酸鉀的還原產物一般為(填化學式)。
(2)查閱資料:XeO3+Mn2++H2O→Xe+MnO4-+H+(未配平,Xe是稀有氣體)。
已知在高錳酸鉀固體表面滴加濃鹽酸,發生的半反應為2Cl--2e-═Cl2↑。
在盛有MnCl2溶液的試管中加入適量XeO3,振蕩試管,可能觀察到的現象是:。
(3)草酸(H2C2O4,二元弱酸)晶體溶于酸性高錳酸鉀溶液,溶液的紫色褪去。離子反應方程式為:。
(4)以鉛蓄電池為電源電解酸化的MnSO4溶液,可制備MnO2。鉛蓄電池的總反應方程式為:;當蓄電池中有4mol H+被消耗時,陽極上MnO2的理論產量為g。
(5)Mn2+催化H2O2分解:2H2O2(l)═2H2O(l)+O2(g)△H1,其反應機理如圖: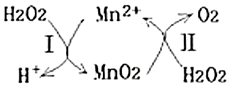
①已知反應Ⅱ為:MnO2(s)+H2O2(l)+2H+(aq)═Mn2+(aq)+O2(g)+2H2O1)△H2,寫出反應Ⅰ的熱化學方程式(焓變用△H1和△H2表示):。
②某溫度時,向10mL0.4mol?L-1H2O2液中滴入1滴MnSO4發生上述分解反應,測得不同時刻生成O2的體積(已折算為標準狀況下體積)如下表:
2~4min時反應速率比0~2min時的慢,其原因是:t/min 0 2 4 6 V(O2)/mL 0 9.9 17.2 22.4 。0~6min的平均反應速率v(H2O2)=(忽略溶液體積變化)。組卷:15引用:1難度:0.6


