2020-2021學(xué)年重慶市銅梁一中高一(下)月考化學(xué)試卷(3月份)
發(fā)布:2024/4/20 14:35:0
一、選擇題(單項選擇題,3分/題,共60分)
-
1.化學(xué)與生產(chǎn)、生活密切相關(guān),下列說法錯誤的是( )
A.葡萄酒中添加二氧化硫,可起殺菌和抗氧化作用 B.德國化學(xué)家哈伯(F.Haber)開發(fā)了合成氨的生產(chǎn)工藝,促進(jìn)了世界農(nóng)業(yè)的發(fā)展 C.二氧化硅可用于飛船的硅太陽能電池 D.燃煤中添加適量CaO可減少SO2排放 組卷:5引用:1難度:0.6 -
2.下列有關(guān)化學(xué)用語正確的是( )
A.中子數(shù)為10的氧原子: O108B.N2的電子式: 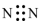
C.鈉離子的結(jié)構(gòu)示意圖: 
D.硫的最高價氧化物對應(yīng)水化物:H2SO4 組卷:4引用:1難度:0.7 -
3.以NA代表阿伏加德羅常數(shù)的值,下列說法中正確的是( )
A.標(biāo)準(zhǔn)狀況下,0.5mol SO3的體積為11.2L B.1mol N2與3mol H2混合可完全反應(yīng),生成NH3分子數(shù)為2NA C.32g S2和S8混合物中含硫原子總數(shù)為NA D.1L 0.5mol?L-1HNO3溶液中氧原子總數(shù)為1.5NA 組卷:18引用:1難度:0.8 -
 4.如右圖所示,將SO2通入下列不同溶液中,實驗現(xiàn)象與所得結(jié)論不正確的是( )
4.如右圖所示,將SO2通入下列不同溶液中,實驗現(xiàn)象與所得結(jié)論不正確的是( )溶液 現(xiàn)象 結(jié)論 A 品紅溶液 紅色溶液褪色 SO2有漂白性 B H2S溶液 產(chǎn)生黃色沉淀 SO2有氧化性 C 酸性KMnO4溶液 紫色溶液褪色 SO2有漂白性 D 滴有酚酞的NaOH溶液 紅色溶液褪色 SO2的水溶液呈酸性 A.A B.B C.C D.D 組卷:151引用:4難度:0.7 -
 5.如圖是某硫酸試劑瓶標(biāo)簽上的部分文字,下列說法不正確的是( )
5.如圖是某硫酸試劑瓶標(biāo)簽上的部分文字,下列說法不正確的是( )A.該硫酸的物質(zhì)的量濃度為18.4mol?L-1 B.2mol Al與足量的該硫酸反應(yīng)生成6g H2 C.該硫酸與等質(zhì)量水混合后所得溶液的質(zhì)量分?jǐn)?shù)等于49% D.向50mL該硫酸溶液中加入足量的銅片,加熱充分反應(yīng)后,被還原的硫酸的物質(zhì)的量小于0.46mol 組卷:32引用:1難度:0.5 -
6.探究銅和濃硫酸的反應(yīng),下列裝置或操作錯誤的是( )
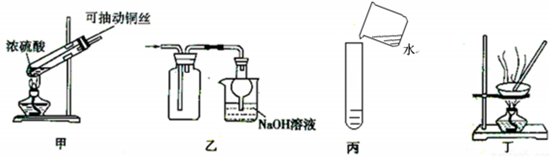
A.上下移動裝置甲中的銅絲可控制SO2的生成 B.裝置乙可用于收集SO2氣體 C.為確認(rèn)甲中有CuSO4生成,向甲中反應(yīng)后的試管中直接加水稀釋,觀察溶液顏色 D.利用裝置丁將硫酸銅溶液加熱濃縮、冷卻結(jié)晶,可析出CuSO4?5H2O晶體 組卷:38引用:1難度:0.5 -
7.下列離子的檢驗方法中,正確的是( )
A.先用鹽酸酸化,再加AgNO3溶液產(chǎn)生白色沉淀,則原溶液中存在Cl- B.先加新制氯水,再加硫氰化鉀溶液,溶液變成紅色,則原溶液中存在Fe2+ C.向某溶液中加入氫氧化鈉溶液,加熱,用濕潤的紅色石蕊試紙靠近試管口,試紙變藍(lán),該溶液中存在NH4+ D.加入過量硝酸酸化,無沉淀產(chǎn)生,再加入BaCl2溶液,產(chǎn)生白色沉淀,則說明原溶液中存在SO42- 組卷:22引用:2難度:0.5 -
8.為了除去粗鹽中的Ca2+、Mg2+、
以及泥沙等雜質(zhì),某同學(xué)設(shè)計了一種制備精鹽的實驗方案,步驟如圖(用于沉淀的試劑均過量)。下列敘述正確的是( )SO2-4
A.第④發(fā)生的反應(yīng)只有CaCl2+Na2CO3═CaCO3↓+2NaCl B.方框中的試劑可以是NaOH溶液也可以是KOH溶液 C.步驟②和④順序可以顛倒 D.⑤步操作用到的玻璃儀器只有燒杯、漏斗和玻璃棒 組卷:53引用:3難度:0.6
二、填空題
-
23.物質(zhì)的類別和核心元素的化合價是研究物質(zhì)性質(zhì)的兩個重要角度。下圖所示是硫及其部分化合物的“價類二維圖”,根據(jù)圖示回答下列問題:
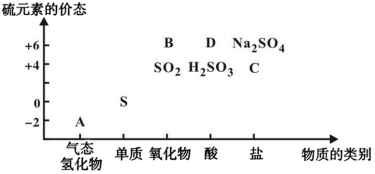
(1)B的化學(xué)式。
(2)A的水溶液在空氣中放置易產(chǎn)生淡黃色渾濁,寫出反應(yīng)的化學(xué)方程式:。
(3)若向Fe2(SO4)3溶液中通入足量的SO2,溶液顏色由棕黃色變?yōu)闇\綠色,寫出反應(yīng)的離子方程式:,反應(yīng)中作還原劑的是。
(4)D的濃溶液與銅單質(zhì)在加熱條件下發(fā)生反應(yīng)的化學(xué)方程式為,反應(yīng)中D表現(xiàn)酸性和。組卷:28引用:1難度:0.8 -
24.任何化學(xué)反應(yīng)都伴隨著能量的變化,通過化學(xué)反應(yīng),化學(xué)能可轉(zhuǎn)化為熱能、光能、電能等不同形式的能量。
(1)用如圖甲、乙所示裝置進(jìn)行實驗,請回答下列問題: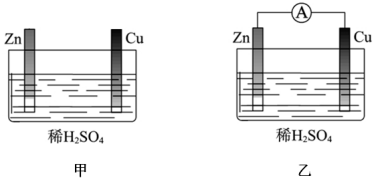
①以下敘述中,正確的是。
a、甲中鋅片是負(fù)極,乙中銅片是正極
b、兩燒杯中銅片表面均有氣泡產(chǎn)生
c、兩燒杯中溶液的pH均增大
d、乙中電流由銅片經(jīng)過導(dǎo)線流向鋅片
②若反應(yīng)過程中有0.4mol電子轉(zhuǎn)移,生成的氫氣在標(biāo)況下的體積為。
(2)Mg、Al設(shè)計成如由圖1所示原電池裝置。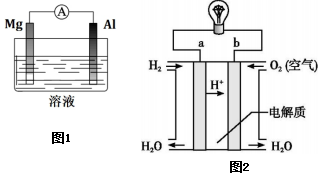
①若溶液為鹽酸,Mg為極。
②若溶液為氫氧化鈉溶液,負(fù)極的電極反應(yīng)為。
(3)已知2mol氫氣完全燃燒生成水蒸氣時放出能量484kJ,且氧氣中1mol O=O鍵完全斷裂時吸收能量496kJ,水蒸氣中1mol H-O鍵形成時放出能量463kJ,則氫氣中1mol H-H鍵斷裂時吸收能量為kJ。
(4)如圖2是氫氧燃料電池構(gòu)造示意圖。
該電池工作時,電子的流向為(填“a→b”或“b→a”),正極的電極反應(yīng)為。組卷:14引用:1難度:0.7


