2022-2023學年廣東省廣州市南海中學高二(上)期末化學試卷
發布:2024/12/31 3:30:2
一、選擇題(本題包括16小題,共44分。其中1~10小題,每小題2分,共20分;11~16小題,每小題2分,共24分。每小題只有一個選項符合題意。)
-
1.下列物質既能導電又是強電解質的是( )
A.氯化鉀溶液 B.氯化鈉晶體 C.熔融態氯化銀 D.液態氯化氫 組卷:42引用:1難度:0.6 -
2.中華傳統文化蘊含著豐富的化學知識,下列詩句中主要涉及吸熱反應的是( )
A.白居易《賦得古原草送別》:“野火燒不盡,春風吹又生。” B.于謙《石灰吟》:“千錘萬鑿出深山,烈火焚燒若等閑。” C.于謙《詠煤炭》:“爝火燃回春浩浩,烘爐照破夜沉沉。” D.李商隱《相見時難別亦難》:“春蠶到死絲方盡,蠟炬成灰淚始干。” 組卷:154引用:14難度:0.7 -
3.在恒溫恒容條件下,可逆反應H2(g)+Br2(g)?2HBr(g)達到化學平衡狀態的標志是( )
A.v正(H2)=2v逆(HBr) B.c(H2)、c(Br2)、c(HBr)不再發生變化 C.c(H2):c(Br2):c(HBr)=1:1:2 D.氣體的密度不再發生變化 組卷:102引用:1難度:0.6 -
4.下列事實能說明氫氟酸是弱電解質的是( )
①25℃時NaF溶液的pH大于7
②用HF溶液做導電試驗,燈泡很暗
③HF溶液不與Na2SO4溶液反應
④0.1mol?L-1HF溶液的pH≈2.3A.①④ B.①②③ C.①②④ D.①②③④ 組卷:43引用:2難度:0.6 -
5.下列說法中,正確的是( )
A.O2轉化變為O3時,熵減小 B.使用催化劑能使非自發反應轉化成自發反應 C.室溫下Ba(OH)2?8H2O晶體與NH4Cl晶體的反應是非自發反應 D.某反應2X(g)?Y(g)+3Z(g)在高溫時能自發進行,其逆反應在低溫時能自發進行,則該反應的正反應的ΔH<0、ΔS>0 組卷:59引用:1難度:0.8 -
 6.利用如圖裝置通過測定反應過程中放出的熱量可測定中和反應反應熱。下列關于該實驗的說法正確的是( )
6.利用如圖裝置通過測定反應過程中放出的熱量可測定中和反應反應熱。下列關于該實驗的說法正確的是( )A.燒杯間的碎泡沫塑料的主要作用是固定燒杯的位置 B.如果沒有玻璃攪拌器,酸堿混合后可用溫度計輕輕攪拌 C.完成一次中和反應反應熱測定實驗,溫度計需要使用2次,分別用于測混合液的初始溫度和反應最高溫度 D.由H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ?mol-1可知,0.5L0.1mol?L-1稀H2SO4溶液與0.5L0.2mol?L-1NaOH稀溶液完全反應,理論上放出熱量為5.73kJ 組卷:101引用:1難度:0.7
二、非選擇題:(本題共4小題,共56分。)
-
19.氧族元素及其化合物在生產、生活中發揮著重要的作用。回答下列問題:
(1)工業上常用硫化物(FeS等)作沉淀劑除去廢水中的Cu2+等重金屬離子。已知常溫下CuS飽和溶液中,-lgc(Cu2+)和-lgc(S2-)關系如圖所示,Ksp(CuS)=;圖中a、b、c三點對應的溶液中,一定存在CuS沉淀的是(填序號)。
(2)工業上將含硒工業廢料處理得到亞硒酸(H2SeO3)和硒酸(H2SeO4),進而制備單質硒。亞硒酸(H2SeO3)在溶液中存在多種微粒形態,25℃時各微粒的分布系數δ與溶液pH的關系如圖所示。(分布系數即各組分的平衡濃度占總濃度的分數)
①將NaOH溶液滴入H2SeO3溶液中,當pH=7.0時發生反應的離子方程式為。
②由圖可知,25℃時NaHSeO3溶液的pH7,通過計算和必要的文字加以解釋:。
③已知硒酸的電離方程式為:H2SeO4=H++,HSeO-4?H++HSeO-4,25℃時,下列關于0.1mol?L-1NaHSeO4溶液的說法錯誤的是SeO2-4。
A.c(H+)=c(OH-)+c()+c(H2SeO4)SeO2-4
B.c(Na+)+c(H+)=c()+2c(HSeO-4)+c(OH-)SeO2-4
C.c(Na+)>c(H+)>c()>c(HSeO-4)>c(OH-)SeO2-4
D.0.1mol?L-1NaHSeO4溶液一定呈酸性組卷:54引用:1難度:0.6 -
20.某科研小組以平板液晶顯示屏生產過程中產生的廢玻璃粉末(含CeO2、SiO2、Fe2O3等)為原料回收Ce的流程如圖所示。
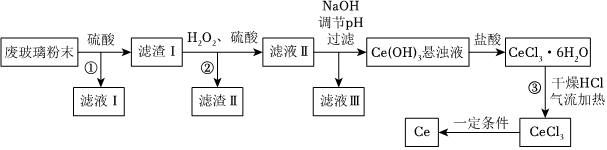
已知:Ce的常見化合價為+3和+4,CeO2具有強氧化性,一般不與常見的無機酸反應。回答下列問題:
(1)為了加快廢玻璃粉末的酸浸速率,通常采用的方法有(寫兩種)。
(2)加入H2O2只作還原劑,該反應的離子方程式為。操作③在加熱的條件下通入干燥HCl氣流的作用是。
(3)25℃當加入NaOH調節溶液pH=9時,Ce(OH)3懸濁液中c(Ce3+)=mol/L。[已知:25℃時,Ce(OH)3的Ksp=8.0×10-21]
(4)三室式電滲析法處理濾液Ⅲ的原理如圖所示,采用惰性電極,ab、cd均為離子交換膜。充分電解后,可以得到循環至該流程使用的物質有。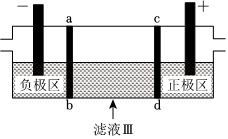
(5)測定CeCl3樣品純度的方法如下:準確稱量樣品12.50g配成200mL溶液,取50.00mL上述溶液置于錐形瓶中,加入稍過量的過二硫酸銨[(NH4)2S2O8]溶液使Ce3+被氧化為Ce4+,然后用萃取劑萃取Ce4+,再用1.000mol/L的FeSO4標準液滴定至終點,重復2~3次,平均消耗10.00mL標準液。
①滴定過程中發生反應的離子方程式為。
②CeCl3樣品的純度為。[已知M(CeCl3)=246.5g/mol,結果保留2位小數]。組卷:14引用:1難度:0.6


