2022-2023學年廣東省廣州一中高二(上)期末化學試卷
發布:2024/11/15 17:0:2
一、選擇題(共16小題,每小題3分,滿分48分)
-
1.最新報道:科學家首次用X射線激光技術觀察到CO與O在催化劑表面形成化學鍵的過程。反應過程的示意圖如下:下列說法正確的是( )
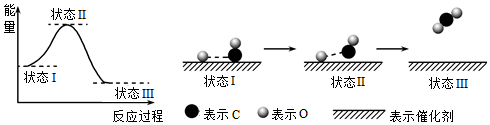
A.CO和O生成CO2是吸熱反應 B.在該過程中,CO斷鍵形成C和O C.CO和O生成了具有極性共價鍵的CO2 D.狀態Ⅰ→狀態Ⅲ表示CO與O2反應的過程 組卷:545引用:88難度:0.7 -
2.某無色透明的溶液,在pH=0和pH=14的條件下都能大量共存的是( )
A.Fe2+、K+、SO42-、NO3- B.Mg2+、NH4+、SO42-、Cl- C.Na+、K+、SO42-、NO3- D.Ba2+、Na+、NO3-、SO42- 組卷:21引用:2難度:0.7 -
3.已知在1200℃時,天然氣脫硫工藝中會發生下列反應:
①H2S(g)+O2(g)═SO2(g)+H2O(g) ΔH132
②2H2S(g)+SO2(g)═S2(g)+2H2O(g) ΔH232
③H2S(g)+O2(g)═S(g)+H2O(g) ΔH312
④2S(g)═S2(g) ΔH4
則ΔH4的正確表達式為( )A.ΔH4= (ΔH1+ΔH2-3ΔH3)23B.ΔH4= (3ΔH3-ΔH1-ΔH2)23C.ΔH4= (ΔH1+ΔH2-3ΔH3)32D.ΔH4= (ΔH1-ΔH2-3ΔH3)32組卷:389引用:6難度:0.5 -
4.化學用語不正確的是( )
A.醋酸的電離:CH3COOH?CH3COO-+H+ B.碳酸氫鈉在水溶液中的電離:NaHCO3?Na++ HCO-3C.氯化銨的水解: +H2O?NH4OH+H+NH+4D.碳酸鈣的溶解平衡:CaCO3(s)?Ca2+(aq)+ (aq)CO2-3組卷:125引用:11難度:0.9 -
5.在一恒溫密閉容器中,反應mA(g)?nB(g)+nC(g)達到平衡后,將容器容積擴大到原來的2倍,當達到新的平衡時,B和C的濃度均是原來的80%,下列說法正確的是( )
A.m<n B.物質A的轉化率增大 C.物質C的質量分數減少 D.平衡向逆反應方向移動 組卷:69引用:2難度:0.5 -
6.下列事實中,不能用勒夏特列原理解釋的是( )
①Fe(SCN)3溶液中加入固體KSCN后顏色變深
②向稀鹽酸中加入少量蒸餾水,鹽酸中氫離子濃度降低
③實驗室常用排飽和食鹽水的方法收集氯氣
④棕紅色NO2加壓后顏色先變深后變淺
⑤加入催化劑有利于合成氨的反應
⑥由H2(g)、I2(g)和HI(g)組成的平衡體系加壓后顏色變深
⑦500℃時比室溫更有利于合成氨的反應
⑧將混合氣體中的氨液化有利于合成氨反應A.①②⑥⑧ B.①③⑤⑦ C.②⑤⑥⑦ D.②③⑦⑧ 組卷:256引用:10難度:0.6
二、解答題(共4小題,滿分52分)
-
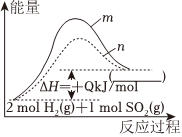 19.將煙氣中的SO2選擇性還原為單質硫是一種具有經濟效益和社會效益的脫硫方法。
19.將煙氣中的SO2選擇性還原為單質硫是一種具有經濟效益和社會效益的脫硫方法。
Ⅰ.氫氣還原法
反應a:2H2(g)+SO2(g)═S(l)+2H2O(g)ΔH=+QkJ/mol
(1)圖中曲線表示了反應a在有、無催化劑條件下反應過程中體系的能量變化。
①曲線(填“m”或“n”)表示的是有催化劑參與的過程。
②圖中括號內應該填寫。
(2)已知:
ⅰ.2H2(g)+O2(g)═2H2O(g)ΔH1
ⅱ.S(s)+O2(g)═SO2(g)ΔH2
ⅲ.ΔH3
利用ΔH1、ΔH2、ΔH3可計算出反應a的焓變。將過程ⅲ補寫完整。
Ⅱ.一氧化碳還原法
反應b:2CO(g)+SO2(g)?S(l)+2CO2(g)ΔH=-37.0kJ/mol
(3)向恒溫恒容密閉容器中充入一定量的CO和SO2,發生反應b。下列描述可判斷該反應達到平衡狀態的是(填標號)。
A.2v(SO2)=v(CO2)
B.CO2氣體的濃度不再變化
C.容器內的總壓強不再變化
D.c(CO):c(SO2):c(CO2)=2:1:2
E.混合氣體的密度不再變化
(4)某溫度時,向2L的密閉容器中充入4molCO和2molSO2,發生反應b,tmin時反應達平衡狀態,測得SO2的平衡轉化率為80%。
①0~tmin內,v(CO2)=mol/(L?min)(用含t的代數式表示)。
②該溫度下,反應b的平衡常數K=L/mol。
③tmin后,向該密閉容器中再充入1.2molCO和1.2molSO2,此時v正(填“>”“<”或“=”)v逆。
(5)向兩個密閉容器中分別充入4molCO和2molSO2,發生反應b,在不同的溫度和壓強下(物質狀態未發生改變),SO2的平衡轉化率(α)如下表所示,其中α1>α2,則T1(填“>”“<”或“=”)T2,判斷的理由是。壓強/MPa P 2P 溫度/℃ T1 T2 SO2的平衡轉化率α/% α1 α2 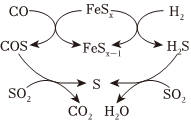
Ⅲ.FeSx化水煤氣(CO、H2)還原SO2
(6)該方法的部分反應過程如圖所示。下列說法合理的是(填標號)。
A.COS和H2S為中間產物
B.可能存在反應FeSx-1+S═FeSx
C.生成S的所有反應中,S均為還原產物
D.尋找更高效催化劑可提高S單質的平衡產率組卷:22引用:1難度:0.6 -
20.(1)綠色電源“直接二甲醚(CH3OCH3)燃料電池”的工作原理示意圖如圖所示:
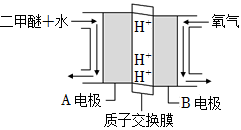
正極為(填“A電極”或“B電極”),H+移動方向為由到(填“A”或“B”),寫出A電極的電極反應式:。
(2)SO2和NOx是主要大氣污染物,利用如圖裝置可同時吸收SO2和NO。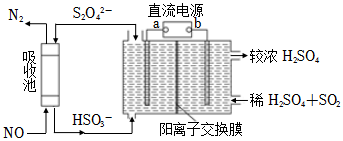
①a是直流電源的極。
②已知電解池的陰極室中溶液的pH在4~7之間,陰極的電極反應為。
③用離子方程式表示吸收NO的原理。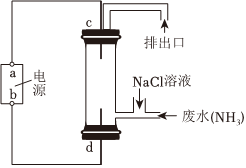
(3)結合如圖所示的電解裝置可去除廢水中的氨氮。
已知除廢水中的氨氮的原理是:3HClO+2NH3=N2+3HCl+3H2O。
①a極為。
②d極反應式為。
(4)VB2空氣電池是目前儲電能力最高的電池。
以VB2空氣電池為電源,用惰性電極電解硫酸銅溶液如圖所示,該電池工作時的反應為4VB2+11O2═4B2O3+2V2O5,VB2極發生的電極反應為。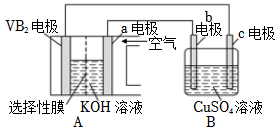
當外電路中通過0.04mol電子時,B裝置內共收集到0.448L氣體(標準狀況),若B裝置內的液體體積為200mL(電解前后溶液體積不變),則電解前CuSO4溶液的物質的量濃度為mol?L-1。組卷:121引用:1難度:0.6


