魯科版(2019)選擇性必修1《3.1 水與水溶液》2020年同步練習(xí)卷(3)
發(fā)布:2024/4/20 14:35:0
-
1.1mol?L-1的下列物質(zhì)的溶液導(dǎo)電性最強(qiáng)的是( )
A.CuSO4 B.NaCl C.CH3COOH D.NH3?H2O 組卷:31引用:3難度:0.8 -
2.下列電離方程式書寫正確的是( )
A.NaHCO3═Na++H++CO32- B.HF═H++F- C.KAl(SO4)2═K++Al3++2SO42- D.CH3COONH4?CH3COO-+NH4+ 組卷:24引用:1難度:0.6 -
3.在四份相同濃度的稀硫酸中分別緩慢滴加下列溶液,其導(dǎo)電能力先減弱至最弱,然后又逐漸增強(qiáng)的是( )
A.NaOH溶液 B.Ba(OH)2溶液 C.BaCl2溶液 D.氨水 組卷:18引用:1難度:0.8 -
4.下列物質(zhì)或措施能促進(jìn)水的電離的是( )
A.加熱 B.醋酸 C.氫氧化鈉 D.氯化鈉 組卷:10引用:1難度:0.8 -
5.下列關(guān)于水的離子積常數(shù)的敘述正確的是( )
A.溫度一定,因?yàn)樗碾x子積的表達(dá)式是KW=c平(H+)?c平(OH-),所以KW隨溶液中c平(H+)和c平(OH-)的變化而變化 B.水的離子積KW與溶液中的溶質(zhì)有關(guān) C.水的離子積僅僅是溫度的函數(shù),隨著溫度的變化而變化 D.水的離子積KW與溫度和溶液中的溶質(zhì)都有關(guān) 組卷:21引用:1難度:0.7 -
6.關(guān)于強(qiáng)、弱電解質(zhì)敘述正確的是( )
A.強(qiáng)電解質(zhì)都是離子化合物,弱電解質(zhì)都是共價(jià)化合物 B.強(qiáng)電解質(zhì)都是可溶性化合物,弱電解質(zhì)都是難溶性化合物 C.強(qiáng)電解質(zhì)的水溶液中無(wú)溶質(zhì)分子,弱電解質(zhì)的水溶液中有溶質(zhì)分子 D.強(qiáng)電解質(zhì)的水溶液導(dǎo)電能力強(qiáng),弱電解質(zhì)的水溶液導(dǎo)電能力弱 組卷:111引用:14難度:0.9
-
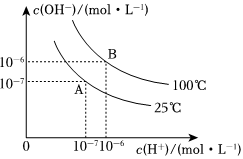 17.在水的電離平衡中,c(H+)和c(OH-)的關(guān)系如圖所示:
17.在水的電離平衡中,c(H+)和c(OH-)的關(guān)系如圖所示:
(1)A點(diǎn)水的離子積為1×10-14,B點(diǎn)水的離子積為.
造成水的離子積變化的原因是
(2)100℃時(shí),若向溶液中滴加鹽酸,能否使體系處于B點(diǎn)位置?為什么?.
(3)100℃時(shí),若鹽酸中c(H+)=5×10-4 mol?L-1,則由水電離產(chǎn)生的c(H+)是多少?組卷:72引用:7難度:0.5 -
18.(1)某溫度(t℃)時(shí),水的離子積KW=1×10-12mol2?L-2,則該溫度
。(填“>”、“<”或“=”)25℃,其理由是。
(2)該溫度下,c平(H+)=1×10-7mol?L-1的溶液中只存在NaOH溶質(zhì),則由H2O電離出來(lái)的c水(OH-)=mol?L-1。
(3)實(shí)驗(yàn)室用Zn和稀硫酸反應(yīng)制取H2,反應(yīng)時(shí)溶液中水的電離平衡(填“向左”、“向右”或“不”,下同)移動(dòng)。在新制氯水中加入少量NaCl固體,水的電離平衡移動(dòng)。
(4)25℃時(shí),0.1mol?L-1的下列4種溶液,水電離出的c平(H+)由大到小的關(guān)系是。(填序號(hào))
①鹽酸
②H2SO4
③NaOH
④Ba(OH)2
(5)25℃時(shí),pH=4的鹽酸中水的電離程度,pH=10的Ba(OH)2溶液中水的電離程度。組卷:49引用:2難度:0.7


