2021-2022學年河南省信陽高級中學高一(下)第一次月考化學試卷
發布:2024/11/8 1:30:2
一、選擇題(共15小題,每小題3分,滿分45分)
-
1.生活離不開化學,下列說法錯誤的是( )
A.喝補鐵劑(含Fe2+)時,加服維生素C效果更好,因維生素C具有還原性 B.膠粒不能透過半透膜,血液透析利用半透膜將有害粒子移出體外 C.小蘇打可用于制作糕點的膨松劑,蘇打可用于治療胃酸過多 D.過氧化鈉既可用作呼吸面具中氧氣的來源,又可漂白織物等 組卷:43引用:2難度:0.7 -
2.水是生命之源。城市生活用水經自來水廠凈化處理的過程如圖。下列說法錯誤的是( )

A.通過反應沉淀池、過濾池除去水中不溶性雜質 B.吸附池內常用活性炭吸附色素和異味 C.自來水廠投入明礬進行消毒 D.硬度較高的自來水,用戶可用煮沸的方法來降低其硬度 組卷:22引用:1難度:0.7 -
3.關于下列氧化還原反應說法正確的是( )
A.對于11PH3+24CuSO4+12H2O3═3H3PO4+24H2SO4+8Cu3P↓反應中每24molCuSO4氧化11molPH3 B.在淀粉和I2的混合溶液中滴加KSCN溶液[已知:(SCN)2、SCR-分別與鹵素單質、鹵素離子性質相似],溶液仍為藍色,證明氧化性:(SCN)2<I2 C.K2H3IO6+9HI═2KI+4I2+6H2O,還原劑與氧化劑的物質的量之比為7:1 D.6I2+11KClO3+3H2O 6KH(IO3)2+5KCl+3Cl2↑,產生22.4L(標準狀況)Cl2時,反應中轉移l0mole-△組卷:88引用:2難度:0.5 -
 4.某同學向實驗室制取CO2的廢液中逐滴滴入Na2CO3溶液至過量,記錄滴入Na2CO3溶液質量(x)與有關量的變化關系如圖所示。下列判斷不正確的是( )
4.某同學向實驗室制取CO2的廢液中逐滴滴入Na2CO3溶液至過量,記錄滴入Na2CO3溶液質量(x)與有關量的變化關系如圖所示。下列判斷不正確的是( )A.圖中縱坐標(y)表示生成CO2的質量 B.反應進行到A點時,溶液中的溶質有2種;反應進行到B點時,溶液中的溶質只有1 種:反應進行到C點時,溶液中的溶質有2種 C.0A段溶液的pH增大,AB段溶液的pH不變,BC段溶液的pH增大 D.縱坐標(y)表示氯化鈣的質量,則反應過程可以用圖2表示 組卷:69引用:2難度:0.6 -
5.下列說法正確的是( )
A.SO2能使酸性KMnO4溶液褪色,故SO2有漂白性 B.NO2與水反應生成HNO3,故NO2是酸性氧化物 C.H2SiO3的酸性弱于H2CO3,故非金屬性C強于Si D.CaCO3難溶于水,故CO2能與CaCl2溶液反應 組卷:63引用:3難度:0.6 -
6.某興趣小組利用如圖所示裝置制備亞氯酸鈉(NaClO2)(已知:SO2與NaClO3在酸性條件下反應生成ClO2)。下列說法錯誤的是( )

A.裝置A中使用70%的濃硫酸效果較好 B.一段時間后,裝置B中有NaClO2晶體析出 C.裝置C中溫度不能太高,可以采用水浴控制溫度 D.裝置D用于吸收酸性尾氣,防止污染空氣 組卷:27引用:3難度:0.6
二、解答題(共4小題,滿分55分)
-
18.硫氰化鉀(KSCN)俗稱玫瑰紅酸鉀,是一種用途廣泛的化學藥品。某實驗小組模擬工業備硫氧化鉀的方法,設計實驗如圖:

已知:CS2是一種不溶于水、密度火于水的非極性試劑。請回答下列問題:
Ⅰ.制備NH4SCN溶液
(1)裝置A用于制備NH3,圓底燒瓶內的固體a是(填名稱)。
(2)三頸燒瓶內盛放有CS2、水和固體催化劑,發生反應CS2+3NH3NH4SCN+NH4HS水浴加熱實驗開始時,打開K2和K1,水浴加熱裝置B,反應發生。三頸燒瓶左側導管口必須插入CS2中,其目的是使反應更充分且催化劑水浴加熱。
(3)一段時間后,當觀察到三頸燒瓶內時,停止通入氣體,反應完成。
Ⅱ.制備KSCN溶液
(4)關閉K1,將三頸燒瓶繼續加熱至100℃,待NH4HS完全分解后,再打開K3,繼續保持水浴溫度為100℃,緩緩滴入稍過量的KOH溶液,制得KSCN溶液。發生反應的化學方程式為;酸性K2Cr2O7溶液除可以吸收NH3外,還能吸收的氣體是。
Ⅲ.制備KSCN 晶體
(5)先通過過濾除去三頸燒瓶中的固體催化劑,再通過蒸發濃縮、冷卻結晶、過濾、洗滌、干燥,得到硫氰化鉀晶體。該提取過程中一定不用的儀器有(填序號)。
①坩堝
②蒸發皿
③長頸漏斗
④玻璃棒
⑤燒杯
⑥直形冷凝管
(6)測定晶體中KSCN的含量:稱取10.0g樣品,配成1000mL溶液。量取25.00mL 溶液錐形瓶中,加入適量稀硝酸,再加入幾滴鐵鹽溶液作指示劑,用0.1000mol/LAgNO3準溶液滴定,達到滴定終點,一次滴定平均消耗AgNO3標準溶液20.00mL。
①滴定時發生的反應:SCN-+Ag+═AgSCN↓(白色),則指示劑的化學式為(填序號)。
A.FeCl3
B.Fe(NO3)3
C.Fe2(SO4)3
D.Fe(SCN)3
②晶體中KSCN的質量分數為(計算結果保留三位有效數字)。組卷:63引用:7難度:0.6 -
19.某工廠的工業廢水中含有大量的硫酸亞鐵和較多的銅離子。為了減少污染并變廢為寶,工廠計劃從該廢水中回收硫酸亞鐵和金屬銅,并用硫酸亞鐵制備碳酸亞鐵。請根據如圖所示回答問題(圖中加入試劑均過量)
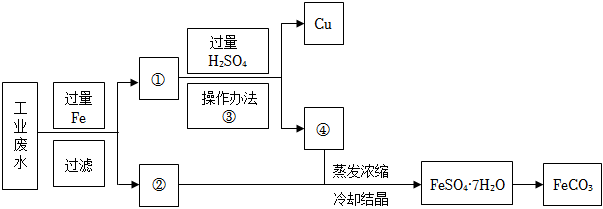
(1)操作方法③是。
(2)取少量溶液④加入試管中,然后滴加過量氫氧化鈉溶液,產生的現象是,此過程中發生的氧化還原反應為(用化學方程式表示)。
(3)制備FeCO3的方程式為FeSO4+Na2CO3═FeCO3↓+Na2SO4。
已知:FeSO4溶液顯酸性,Na2CO3溶液顯堿性,Fe(OH)2在溶液pH=5.8時開始沉淀。
①制備FeCO3時,選用的加料方式是將Na2CO3溶液緩慢加入到盛有FeSO4溶液的反應容器中,這樣操作的原因是。
②生成的FeCO3沉淀需經充分洗滌,檢驗洗滌是否洗凈的實驗方法是。
(4)硫酸亞鐵水溶液易與硫酸銨形成穩定的硫酸亞鐵銨(NH4)aFeb(SO4)c?nH2O,稱為莫爾鹽。稱取7.84g新制莫爾鹽,溶于水配成250mL溶液。取25.00mL該溶液加入足量的BaCl2溶液,得到白色沉淀0.932g;另取25.00mL該溶液用0.0200mol?L-1KMnO4酸性溶液將溶液中的Fe2+氧化為Fe3+,當KMnO4恰好完全被還原為Mn2+時,消耗溶液的體積為20.00mL。
回答下列問題:
①配制硫酸亞鐵水溶液時,需要加入少量鐵粉,鐵粉的作用是。
②用雙線橋標出下列反應中電子的轉移:2KMnO4+10FeSO4+8H2SO4═K2SO4+2MnSO4+5Fe2(SO4)3+8H2O。
③試確定莫爾鹽的化學式(寫出計算過程)。組卷:59引用:2難度:0.6


