2021-2022學年遼寧省大連一中高一(上)第一次段考化學試卷
發布:2024/4/20 14:35:0
一.選擇題:本題共15個小題,每小題4分,共60分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.將下列各組物質依次按酸、堿、鹽分類排列,其中正確的是( )
A.硫酸、純堿、孔雀石 B.硝酸、燒堿、膽礬 C.醋酸、酒精、硫酸鈉 D.鹽酸、生石灰、小蘇打 組卷:4引用:1難度:0.8 -
2.將碳酸鈣通過特殊的加工方法使之變為納米碳酸鈣(碳酸鈣粒子直徑在幾納米~幾十納米之間),會引起建筑材料的性能發生巨變。下列關于納米碳酸鈣的推測正確的是( )
A.納米碳酸鈣的水溶液會渾濁不清 B.納米碳酸鈣化學性質已與原來碳酸鈣完全不同 C.納米碳酸鈣分散到水中能產生丁達爾效應 D.納米碳酸鈣的粒子不能透過濾紙 組卷:4引用:2難度:0.7 -
3.現有氧化鐵、稀硫酸、氫氧化鈉溶液、氯化鋇溶液和碳酸鉀溶液五種物質,在常溫下它們兩兩相互發生的化學反應有( )
A.4個 B.5個 C.6個 D.7個 組卷:16引用:1難度:0.6 -
4.下列能導電的電解質是( )
A.熔融硝酸鉀 B.硫酸銅溶液 C.氯化鈉固體 D.石墨 組卷:8引用:1難度:0.5 -
5.下列反應中水只作氧化劑的是( )
A.SO3+H2O═H2SO4 B.3NO2+H2O═2HNO3+NO C.2F2+2H2O═4HF+O2 D.2Na+2H2O═2NaOH+H2↑ 組卷:9引用:1難度:0.7 -
6.從氧化還原反應的角度分析,下列說法正確的是( )
A.As2O3+6Zn+6H2SO4=2AsH3+6ZnSO4+3H2O,氧化劑和還原劑的物質的量比為6:1 B.3S+6KOH 2K2S+K2SO3+3H2O中,被氧化和被還原的硫元素質量之比為2:1加熱C.2Na2O2+2CO2═2Na2CO3+O2中,每生成1molO2,轉移2mol電子 D.Al2O3+N2+3C 2AlN+3CO中,氧化產物和還原產物物質的量之比為2:3高溫組卷:85引用:3難度:0.6 -
7.下列離子方程式書寫正確的是( )
A.向Ca(OH)2溶液中滴加少量NaHCO3溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O B.氯化鐵溶液中滴加雙氧水:Fe3++2H2O2+H+═O2↑+2H2O+Fe2+ C.銅粉與氯化鐵溶液反應:Cu+Fe3+═Fe2++Cu2+ D.Ba(OH)2溶液與H2SO4反應:Ba2++OH-+H++SO42-═BaSO4↓+H2O 組卷:17引用:1難度:0.6
二、非選擇題:共40分。
-
21.現有NaCl、Na2SO4和NaNO3的混合物,選擇適當的試劑除去雜質,從而得到純凈的NaNO3晶體,相應的實驗流程如圖所示。
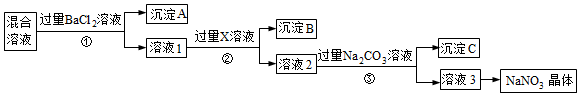
請回答下列問題:
(1)寫出實驗流程中下列物質的化學式:試劑X。
(2)上述實驗流程中①②③步均要進行的實驗操作是(填操作名稱)。
(3)上述實驗流程中加入過量Na2CO3溶液后發生反應的離子方程式:、。
(4)(本小題兩空均填化學式)按此實驗方案得到的溶液3中肯定含有雜質。為了解決這個問題,可以向溶液3中加入適量的。
(5)在①步操作中如何證明加的BaCl2溶液已過量?。組卷:17引用:2難度:0.5 -
22.HNO2是一種弱酸,且不穩定,易分解生成NO和NO2;它是一種還原劑,能被常見的強氧化劑氧化,但在酸性溶液中它也是一種氧化劑,如能把Fe2+氧化成Fe3+。AgNO2是一種難溶于水、易溶于酸的化合物。試回答下列問題:
(1)人體正常的血紅蛋白含有Fe2+。若誤食亞硝酸鹽(如NaNO2),則導致血紅蛋白中的Fe2+轉化為Fe3+而中毒,可以服用維生素C可解毒。下列敘述不正確的是(填序號)。
A.亞硝酸鹽被還原
B.維生素C是還原劑
C.維生素C將Fe3+還原為Fe2+
D.亞硝酸鹽是還原劑
(2)下列方法中,不能用來區分NaNO2和NaCl的是(填序號)。
A.加入稀鹽酸,觀察是否有氣泡產生
B.加入AgNO3,觀察是否有沉淀產生
C.在酸性條件下加入KI-淀粉溶液,觀察溶液顏色(I2遇淀粉呈藍色)
(3)某同學把氯氣通入到NaNO2溶液中,生成NaNO3和HCl,請寫出反應的離子方程式:。
(4)高鐵酸鈉(Na2FeO4)具有強氧化性,可對自來水進行消毒、凈化。高鐵酸鈉可用氫氧化鐵和次氯酸鈉在堿性介質中反應得到,請補充并配平下面離子方程式。Fe(OH)3+ClO-+OH-=FeO42-+Cl-+
(5)在反應11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,氧化劑是。組卷:43引用:3難度:0.6


