2020-2021學年江西省吉安市井岡山市寧岡中學高二(上)期中化學試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(16×3=48,每小題只有一個選項最符合題意)
-
1.下列生產、生活等實際應用,不能用勒夏特列原理解釋的是( )
A.溴水中有下列平衡Br2+H2O HBr+HBrO,當加入AgNO3溶液后溶液顏色變淺B.合成氨工業(yè)中使用鐵觸媒做催化劑 C.合成NH3反應,為提高NH3的產率,理論上應采取低溫度的措施 D.對2HI(g) H2(g)+I2(g),保持容器體積不變,通入氫氣可使平衡體系顏色變淺組卷:92引用:9難度:0.7 -
2.室溫下H2SO4是二元強酸,其稀溶液中,第一步解離是完全的,第二步解離程度較低,HSO4-?H++SO42-(K2=1.0×10-2)。設NA為阿伏加德羅常數的值,下列說法正確的是( )
A.56 g單質鐵與足量稀硫酸反應產生22.4 L H2 B.1 L 0.1 mol/L的硫酸溶液中,含H+的數目為0.2 NA C.室溫下,NaHSO4溶液顯堿性 D.稀硫酸溶液中存在關系:c(HSO4-)+c(OH-)+2c(SO42-)=c(H+) 組卷:51引用:3難度:0.5 -
3.常溫下,下列各組離子在指定溶液中能大量共存的是( )
A.pH=11的溶液:Na+、K+、Cl-、NO3- B.能使石蕊變紅的溶液:Na+、K+、SO42-、CO32- C.0.1mol?L-1KMnO4溶液:NH4+、Na+、NO3-、I- D.0.1mol?L-1AgNO3溶液:NH4+、Mg2+、Cl-、SO42- 組卷:23引用:2難度:0.7 -
 4.已知NO2和N2O4可以相互轉化:2NO2(g)?N2O4(g)△H<0.在恒溫條件下將一定量NO2和N2O4的混合氣體通入一容積為2L的密閉容器中,反應物的濃度隨時間變化關系如圖.下列說法正確的是( )
4.已知NO2和N2O4可以相互轉化:2NO2(g)?N2O4(g)△H<0.在恒溫條件下將一定量NO2和N2O4的混合氣體通入一容積為2L的密閉容器中,反應物的濃度隨時間變化關系如圖.下列說法正確的是( )A.a、b、c、d四個點中,只有b、d點的化學反應處于平衡狀態(tài) B.前10min內用v(NO2)表示的化學反應速率為0.06mol(L?min) C.25min時,導致平衡移動的原因是將密閉容器的體積縮小為1L D.圖中的兩條曲線,X是表示N2O4濃度隨時間變化的曲線 組卷:12引用:3難度:0.7 -
5.自然界中時刻存在著氮的轉化。實現氮按照一定方向轉化一直是科學領域研究的重要課題,如圖為N2分子在催化劑的作用下發(fā)生的一系列轉化示意圖:
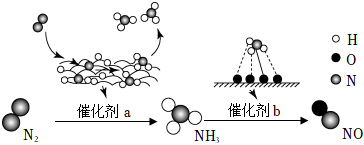
下列敘述正確的是( )A.N2→NH3,NH3→NO均屬于氮的固定 B.催化劑a作用下氮原子發(fā)生了氧化反應 C.催化劑a、b表面均發(fā)生了極性共價鍵的斷裂 D.使用催化劑a、b均可以提高單位時間內生成物的產量 組卷:307引用:29難度:0.7 -
6.將4molA氣體和2molB氣體在2L的容器中混合并在一定條件下發(fā)生如下反應:2A(g)+B(g)?2C(g),2s后測得C的濃度為0.6mol?L-1,下列說法正確的是( )
A.用物質A表示的反應平均速率為0.6mol?L-1?s-1 B.v(B)=2v(C) C.2 s時物質A的轉化率為30% D.2 s時物質B的濃度為0.8mol?L-1 組卷:6引用:2難度:0.4 -
7.下列關于個圖象的解釋或得出的結論正確的是( )

A.圖甲表示燃料燃燒反應的能量變化 B.圖乙可表示酶催化反應的反應速率隨反應溫度的變化 C.圖乙中,在溫度為T1時表示反應達到平衡狀態(tài) D.圖丙表示某溫度時,BaSO4在水中的沉淀溶解平衡曲線,d點有BaSO4沉淀生成 組卷:54引用:2難度:0.7
二、填空題(共52分)
-
21.2SO2(g)+O2(g)?2SO3(g)是工業(yè)生產硫酸的重要步驟,T℃時該反應過程中的能量變化如圖1所示。

(1)2SO2(g)+O2(g)?2SO3(g)△H=kJ?mol-1.(用含E1、E2的計算式表示)
(2)①下列措施不能使該反應速率加快的是。
A.升高溫度 B.降低壓強 C.使用催化劑
②若上述反應在恒容的密閉容器中進行,下列敘述中能說明該反應已達平衡狀態(tài)的是。
A.SO3的濃度不再變化
B.SO2與SO3的物質的量相等
C.容器內氣體的壓強不再變化
D.單位時間內消耗1mol O2,同時消耗2mol SO2
(3)運用電化學原理可生產硫酸,總反應為2SO2+O2+2H2O═2H2SO4,裝置如圖2所示。其中質子交換膜將該原電池分隔成氧化反應室和還原反應室,能阻止氣體通過而允許H+通過。
①該電池的負極是。(填“電極a”或“電極b”)
②H+通過質子交換膜時的移動方向是。
A.從左向右 B.從右向左
③通入O2的電極反應式是。組卷:28引用:2難度:0.6 -
22.碳、氮元素形成的化合物是人類生產生活中的重要物質.請回答下列問題:
(1)有機物M經過太陽光照可轉化成N,轉化過程如圖: ΔH=+88.6kJ?mol-1
ΔH=+88.6kJ?mol-1
①有機物M中σ鍵和π鍵的數目之比為。
②M、N相比,較穩(wěn)定的是。(填代號)
(2)火箭推進器中裝有液態(tài)還原劑肼(N2H4)和強氧化劑過氧化氫(H2O2),如圖是一定量肼完全燃燒生成氮氣和1mol氣態(tài)水過程中的能量變化圖:
①肼(N2H4)分子中所有原子(填“是”或“否”)共平面;
②該反應反應物的總鍵能(填“<”、=“”或“>”)生成物的總鍵能,寫出該火箭推進器中相關反應的熱化學方程式:。
(3)用NH3催化還原NOx還可以消除氮氧化物的污染.已知:
①4NH3(g)+3O2(g)═2N2(g)+6H2O(g) ΔH1=-akJ?mol-1
②N2(g)+O2(g)═2NO(g) ΔH2=-bkJ?mol-1
若1molNH3還原NO至N2,則該反應過程中的反應熱ΔH3=kJ?mol-1(用含a、b的式子表示)。組卷:8引用:2難度:0.6


