2022-2023學年遼寧省協作校高二(上)第一次月考化學試卷
發布:2024/8/31 0:0:8
一、選擇題:本題共15小題,每小題3分,共45分。在每小題給出的四個選項中,只有一項符合題目要求。
-
1.將CO2轉化為燃料甲醇是實現碳中和的途徑之一,在恒溫恒容密閉容器中進行反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)ΔH<0,下列有關說法正確的是( )
A.正反應為熵增過程,ΔS>0 B.該反應在低溫下可自發進行 C.該反應在任意溫度下均可自發進行 D.干冰升華是一個熵減的過程 組卷:19引用:8難度:0.7 -
2.下列措施不能改變相應化學反應速率的是( )
A.在鐵制品表面刷油漆——鐵的腐蝕速率 B.高爐煉鐵增加爐高——CO的反應速率 C.食物放在冰箱中儲存——食物的腐敗速率 D.燒煤時用煤粉代替煤塊——煤的燃燒速率 組卷:99引用:4難度:0.8 -
3.已知相同條件下:①2H2O(g)?O2(g)+2H2(g)K1
②Cl2(g)+H2(g)?2HCl(g)K2
③2Cl2(g)+2H2O(g)?4HCl(g)+O2(g)K3
則K1、K2、K3的關系正確的是( )A.K3=K1+ K22B.K3= K1K22C.K3=K1? K22D.K3=K1- K22組卷:34引用:4難度:0.7 -
4.在標有“20℃50mL”的滴定管內,液面的讀數為46.00,如果將管內液體全部放入量筒內,那么量筒內溶液的體積( )
A.等于4mL B.大于4mL C.小于4mL D.大于46mL 組卷:7引用:3難度:0.5 -
5.下列顏色變化與氧化還原反應無關的是( )
A.新切開的蘋果在空氣中變黃,最終變為褐色 B.白色的硫酸銅固體放置在空氣中變為藍色 C.淡黃綠色的新制氯水久置后變為無色 D.淡黃色的Na2O2固體放置在空氣中,一段時間后變成白色 組卷:17引用:7難度:0.7 -
6.利用下列實驗裝置進行的實驗不能達到相應實驗目的的是( )
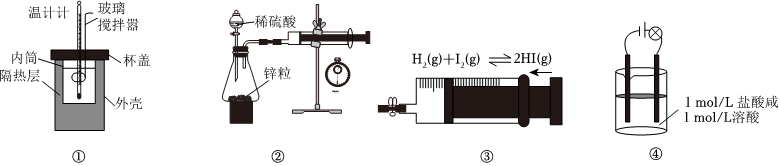
A.①測量中和反應的反應熱 B.②測量鋅與稀硫酸反應的反應速率 C.③探究壓強對平衡的影響 D.④證明醋酸為弱酸 組卷:17引用:3難度:0.5
二、非選擇題:本題共4小題,共55分。
-
18.汽車的發展給我們帶來便利的同時也導致了一些環境問題。請根據所學知識回答下列問題:
(1)已知:燃料C16H34(l)、C8H16(l)、C8H18(l)的燃燒熱ΔH分別為-akJ?mol-1、-bkJ?mol-1、-ckJ?mol-1(a、b、c均大于零),則C16H34(l)→C8H16(l)+C8H18(l)的ΔH=kJ?mol-1。
(2)燃料燃燒時常存在燃燒不充分、尾氣殘留等問題,所以汽車排氣管會加裝三元催化器,催化反應2CO+2NO?2CO+N2進行,催化劑能加快反應速率的原因是。
(3)為探究汽車尾氣的轉化,向一體積為2L的恒容密閉容器中充入2molCO和2molNO,發生反應2CO(g)+2NO(g)?2CO2(g)+N2(g),溫度分別為T1和T2時,CO的轉化率隨時間的變化關系如圖所示。則該反應的ΔH(填“>”、“<”或“=”,下同)0;若T1、T2時該反應的平衡常數分別為K1、K2,則K1K2。
(4)若在300℃、體積為2L的恒容密閉容器中,充入2molCO和2molNO,初始壓強為akPa下進行反應2CO(g)+2NO(g)?2CO2(g)+N2(g),反應過程中,總壓強隨時間的變化關系如圖所示。
①M點時,NO的轉化率為,v(N2)=mol?L-1?s-1。
②300℃下該反應的平衡常數K=。
③平衡后保持其他條件不變,若再充入1.2molCO、1.2molN2,則平衡向(填“正”或“逆”)反應方向移動。組卷:10引用:2難度:0.5 -
19.碘及其化合物廣泛用于醫藥、染料等方面。碘酸是一種強酸,其水溶液有強氧化性.已知氧化性:Cl2>HIO3>Fe3+>I2。回答下列問題:
(1)一種以含有少量I-的廢液為原料制備I2的方法如圖所示:
①“轉化”生成的Ag溶于稀硝酸可獲得硝酸銀,寫出Ag與稀硝酸反應的離子方程式:。
②通入Cl2的過程中,若,則反應中被氧化的元素為n(Cl2)n(FeI2)=12(填元素符號);當>1.5后,單質碘的產率會降低,原因是n(Cl2)n(FeI2)。
(2)大量的碘由自然界的NaIO3與還原劑NaHSO3反應制得,則該制備I2的反應中的氧化劑和還原劑的物質的量之比為。
(3)鹵素互化物IF5可發生水解反應,生成鹵離子和鹵氧離子(為非氧化還原反應),寫出反應的離子方程式:。
(4)碘酸鈣是食品及飼料添加劑中補碘補鈣的常用試劑,微溶于水.Ca(IO3)2?6H2O加熱升溫過程中剩余固體的質量分數隨溫度變化的關系如圖所示。為獲得無水碘酸鈣,可將Ca(IO3)2?6H2O晶體w(剩余固體的質量原始固體的質量)(填實驗操作)。若將加熱溫度提高至540℃,則此時得到固體的主要成分為(填化學式)。 組卷:18引用:5難度:0.5
組卷:18引用:5難度:0.5


