2021-2022學年江蘇省揚州市高郵市臨澤中學高一(上)期末化學試卷
發布:2024/4/20 14:35:0
一、單項選擇題:(4個選項中,只有1個選項是符合要求的,20題共60分)
-
1.2021年新冠肺炎疫情奪走了至少330萬人的生命,化學在攻克這一世界難題中功不可沒,“新型冠狀病毒”由蛋白質外殼和單鏈核酸組成,直徑為60~140nm,怕酒精,不耐高溫。下列說法不正確的是( )
A.“新型冠狀病毒”擴散到空氣中不可能形成膠體 B.“新型冠狀病毒”擴散到空氣中形成的分散系可能具有一定的穩定性 C.蛋白質、酒精屬于有機物 D.減少外出、勤通風可有效預防“新型冠狀病毒”感染 組卷:76引用:10難度:0.7 -
2.下列有關化學用語表述正確的是( )
A.35Cl-和37Cl-的離子結構示意圖均可以表示為 
B.亞硫酸的電離方程式:H2SO3=2H++2 SO2-3C.明礬的化學式:KAlSO4 D.質子數為92、中子數為146的U原子: U14692組卷:23引用:2難度:0.7 -
3.讀下列藥品標簽,有關分析不正確的是( )
選項 A B C D 物品標簽 



分析 該試劑應裝在橡膠塞的細口瓶中 該藥品不能與皮膚直接接觸 該物質受熱易分解 該藥品物質的量濃度為18.4mol?L-1 A.A B.B C.C D.D 組卷:44引用:3難度:0.6 -
4.電解質和非電解質是對化合物的一種分類方式.下列關于電解質的說法正確的是( )
A.液態HCl不導電,所以HCl不是電解質 B.NH3溶于水形成的溶液能導電,所以NH3是電解質 C.SO2溶于水能導電,所以SO2是電解質 D.BaSO4在水溶液中難導電,但熔融狀態下能導電,所以BaSO4是電解質 組卷:323引用:19難度:0.9 -
5.下列關于SO2性質的說法正確的是( )
A.氯水中通入一定量的SO2氣體可增強氯水的漂白性 B.紫色石蕊溶液中通入SO2溶液變紅 C.SO2只可以被氧化 D.含有酚酞的NaOH溶液中通入SO2氣體,溶液變無色,說明SO2具有漂白性 組卷:149引用:2難度:0.6 -
6.下列遞變情況中,正確的是( )
A.Na、Mg、Al原子最外層電子數依次減少 B.P、S、Cl元素非金屬性依次減弱 C.Li、Na、K的金屬性依次增強 D.C、N、O元素最高正價依次增大 組卷:141引用:3難度:0.8 -
7.下列有關實驗描述正確的是( )
A.在某溶液中加入稀鹽酸,產生無色無味的氣體,該氣體能使澄清石灰水變渾濁,證明其中含有 CO2-3B.要證明某燒堿溶液中可能含有Cl-,應先加稀鹽酸酸化,再滴加AgNO3溶液,若有白色沉淀生成,證明其中含有Cl- C.焰色反應時,觀察到火焰呈黃色,可以推測肯定含鈉元素,可能含鉀元素 D.在某溶液中加入BaCl2溶液,產生白色沉淀,加鹽酸,沉淀不溶解,證明其中含有 SO2-4組卷:52引用:4難度:0.8 -
8.在給定條件的水溶液中能大量共存的離子組是( )
A.透明的溶液:Fe3+、K+、NO3-、Cl- B.含有NaHCO3的溶液:SO42-、OH-、K+、CO32- C.使酚酞溶液呈紅色的溶液:Mg2+、Ba2+、NO3-、K+ D.c(H+)=1mol?L-1的溶液:K+、Na+、Cl-、OH- 組卷:83引用:1難度:0.7
二、非選擇題(本部分4題,共40分)
-
23.SO2是常見的大氣污染物,燃煤是產生SO2的主要原因.工業上有多種方法可以減少SO2的排放.
(1)往煤中添加一些石灰石,可使燃煤過程中產生的SO2轉化成硫酸鈣.該反應的化學方程式是.
(2)可用多種溶液做燃煤煙氣中SO2的吸收液.
①分別用等物質的量濃度的Na2SO3溶液和NaOH溶液做吸收液,當生成等物質的量NaHSO3時,兩種吸收液體積比V(Na2SO3):V(NaOH)=.
②NaOH溶液吸收了足量的SO2后會失效,可將這種失效的溶液與一定量的石灰水溶液充分反應后過濾,使NaOH溶液再生,再生過程的離子方程式是.
(3)甲同學認為BaCl2溶液可以做SO2的吸收液.為此甲同學設計如圖1實驗(夾持裝置和加熱裝置略,氣密性已檢驗):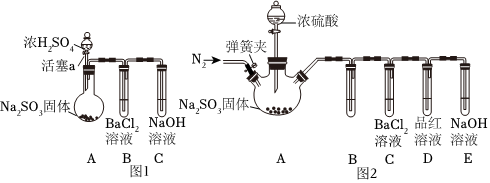
已知:Na2SO3(固體)+H2SO4(濃)Na2SO4+SO2↑+H2O△
反應開始后,A中Na2SO3固體表面有氣泡產生同時有白霧生成;B中有白色沉淀.甲認為B中白色沉淀是SO2與BaCl2溶液反應生成的BaSO3,所以BaCl2溶液可做SO2吸收液.
乙同學認為B中的白色沉淀是BaSO4,產生BaSO4的原因是:
①A中產生的白霧是濃硫酸的酸霧,進入B中與BaCl2溶液反應生成BaSO4沉淀.
②.
為證明SO2與BaCl2溶液不能得到BaSO3沉淀,乙同學對甲同學的實驗裝置做了如圖2改動并實驗(夾持裝置和加熱裝置略,氣密性已檢驗):反應開始后,A中Na2SO3固體表面有氣泡產生同時有白霧生成;B、C試管中除了有氣泡外,未見其它現象;D中紅色褪去.
③試管B中試劑是溶液;滴加濃硫酸之前的操作是.
④通過甲乙兩位同學的實驗,得出的結論是.組卷:135引用:4難度:0.1 -
24.NaClO2?3H2O具有強氧化性,在消毒和果蔬保鮮等方面有廣泛應用。
I.如圖是制備NaClO2?3H2O的一種流程: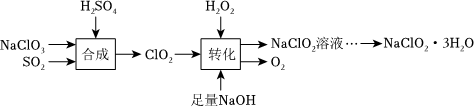
已知:NaClO2飽和溶液在低于38℃時析出NaClO2?3H2O,高于38℃時析出NaClO2。
(1)寫出“合成”中發生反應的離子方程式:,若生成2mol ClO2時,電子轉移的數目是。
(2)“轉化”過程中,H2O2的作用是(選填“氧化劑”或“還原劑”)。
(3)由NaClO2溶液得到NaClO2?3H2O的操作為:蒸發濃縮,,過濾洗滌,得到NaClO2?3H2O產品。
II.為確定產品的純度,進行如下實驗:
步驟1:取20.00gNaClO2?3H2O樣品,溶于經煮沸冷卻后的蒸餾水,配成200.00mL溶液。
步驟2:取出20.00mL配制的溶液于錐形瓶中,加入略過量的1.000mol/LKI溶液,塞上瓶塞。充分反應后,向錐形瓶中滴加兩滴淀粉溶液,用2.000mol/LNa2S2O3溶液滴定至終點。
步驟3:重復以上操作2~3次,測得滴定Na2S2O3溶液的平均體積為22.00mL。
已知:+4I-+4H+=Cl-+2I2+2H2O,I2+2S2ClO-2=2I-+S4O2-3。試計算該NaClO2?3H2O樣品的純度O2-6(寫出計算過程)。組卷:110引用:1難度:0.5


