2022-2023學年河南省洛陽市洛寧一高高二(上)段考化學試卷(8月份)
發布:2024/11/26 9:0:1
一、單選題(每題3分)
-
1.N2H4是一種高效清潔的火箭燃料。0.25molN2H4(g)完全燃燒生成氮氣和氣態水時,放出133.5kJ熱量。則下列熱化學方程式中正確的是( )
A.N2H4(g)+O2(g)=N2(g)+2H2O(g)ΔH=534kJ?mol-1 B.N2H4(g)+O2(g)=N2(g)+2H2O(g)ΔH=-534kJ?mol-1 C.N2H4(g)+O2(g)=N2(g)+2H2O(g)ΔH=+534kJ?mol-1 D.N2H4(g)+O2(g)=N2(g)+2H2O(l)ΔH=-133.5kJ?mol-1 組卷:94引用:2難度:0.7 -
2.下列有關化學反應速率的說法正確的是( )
A.用鐵片和稀硫酸反應制取氫氣時,改用98%的濃硫酸可以加快產生氫氣的速率 B.100 mL 2 mol/L的鹽酸跟鋅片反應,加入適量的氯化鈉溶液,反應速率不變 C.SO2的催化氧化是一個放熱反應,所以升高溫度,反應速率減慢 D.催化劑能降低分子活化時所需能量,使單位體積內活化分子百分數大大增加 組卷:160引用:9難度:0.9 -
3.已知:
①2H2 (g)+O2 (g)=2H2O(l)ΔH=-571.6kJ?mol-1
②2CH3OH(1)+3O2 (g)=2CO2 (g)+4H2O(l)ΔH=-1452kJ?mol-1
③H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ?mol-1
④Ba2+(aq)+SO42-(aq)=BaSO4 (s)ΔH<0
下列說法正確的是( )A.H2(g)的燃燒熱為571.6kJ?mol-1 B. H2SO4(aq)+12Ba(OH)2(aq)=12BaSO4(s)+H2O(l)ΔH=-57.3kJ?mol-112C.相同質量的H2(g)和CH3OH(l)完全燃燒,H2(g)放出的熱量多 D.3H2(g)+CO2(g)=CH3OH(1)+H2O(l)ΔH=+131kJ?mol-1 組卷:69引用:5難度:0.8 -
4.下列有關熱化學方程式的敘述中,正確的是( )
A.含20.0gNaOH的稀溶液與足量的稀硫酸完全中和,放出28.7kJ的熱量,則表示中和熱的熱化學方程式為2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-114.8kJ?mol-1 B.已知熱化學方程式:SO2(g)+ O2(g)?SO3(g)△H=-98.32kJ?mol-1,在容器中充入2molSO2和1molO2充分反應,最終放出的熱量為196.64kJ12C.已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1,則H2的燃燒熱為241.8kJ?mol-1 D.已知石墨轉化為金剛石為吸熱,那么石墨比金剛石穩定 組卷:28引用:4難度:0.6 -
 5.已知化學反應X(g)+2Y(g)=2Z(g) 的能量變化如圖所示,下列有關該反應的說法正確的是( )
5.已知化學反應X(g)+2Y(g)=2Z(g) 的能量變化如圖所示,下列有關該反應的說法正確的是( )A.該反應是放熱反應 B.反應物的總鍵能大于生成物的總鍵能 C.Y的能量高于Z的能量 D.該反應的反應熱ΔH>0 組卷:26引用:4難度:0.7 -
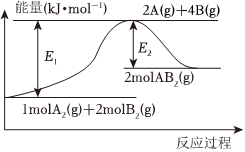 6.已知某化學反應2B2A(g)═A2(g)+2B2(g)(B2A、A2、B2的分子結構分別為B-A-B、A=A、B-B)的能量變化如圖所示,下列有關敘述不正確的是( )
6.已知某化學反應2B2A(g)═A2(g)+2B2(g)(B2A、A2、B2的分子結構分別為B-A-B、A=A、B-B)的能量變化如圖所示,下列有關敘述不正確的是( )A.該反應的進行一定需要加熱 B.該反應的△H=(E1-E2) kJ?mol-1 C.由2mol A(g)和4mol B(g)形成1mol A=A鍵和2mol B-B鍵,放出E2kJ能量 D.該反應中,反應物的鍵能總和大于生成物的鍵能總和 組卷:67引用:5難度:0.7 -
7.已知化學反應A2(g)+B2(g)═2AB(g)的能量變化如圖所示,下列敘述中正確的是( )

A.該反應為放熱反應 B.該反應中反應物的總能量高于生成物的總能量 C.當生成1mol氣體AB時,吸收 kJ能量(a-b)2D.斷裂1mol A-A和1mol B-B化學鍵共放出(a-b)kJ能量 組卷:100引用:4難度:0.5
二.非選擇題(除祕外每題2分)
-
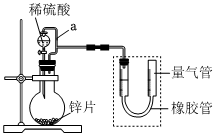 20.影響化學反應速率的因素有很多,某課外興趣小組用實驗的方法進行探究。
20.影響化學反應速率的因素有很多,某課外興趣小組用實驗的方法進行探究。
實驗一:某同學設計如圖所示裝置(部分夾持裝置已略去)進行實驗探究。回答下列問題:
(1)a管的作用。
(2)等質量的鋅分別與4份50mL過量的稀硫酸在不同的實驗條件下完全反應,實驗數據如下表:
①實驗實驗組別 c(H2SO4)/mol/L-1 反應前溫度/℃ 金屬狀態 1 1.0 20 塊狀 2 1.6 25 塊狀 3 1.6 30 塊狀 4 1.6 25 粉末狀 (填實驗組別序號)可表明實驗溫度對反應速率產生影響。
②實驗2和4表明也可對反應速率產生影響。100mL1mol?L-1的稀硫酸與過量鋅粒反應,一定溫度下,為了減緩反應速率,又不影響生成氫氣的總量,可采取的措施是。
A.加入少量NaNO3粉末
B.加入少量CuSO4溶液
C.加入適量Na2SO4溶液
D.加熱
實驗二:已知:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,酸性KMnO4溶液和H2C2O4溶液反應時,開始一段時間反應速率較慢,溶液褪色不明顯;但不久突然褪色,反應速率明顯加快。
(3)針對上述現象,某同學認為該反應放熱,導致溶液溫度上升,反應速率加快。從影響化學反應速率的因素看,你猜想還可能是的影響。
(4)若用實驗證明你的猜想,除酸性KMnO4溶液、H2C2O4溶液外,可以在反應一開始時加入(填標號)。
A.K2SO4
B.MnSO4
C.MnCl2
D.H2O組卷:19引用:4難度:0.5 -
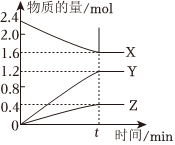 21.某溫度下,在2L密閉容器中X、Y、Z三種物質(均為氣態)間進行反應,其物質的量隨時間的變化曲線如圖。據圖回答:
21.某溫度下,在2L密閉容器中X、Y、Z三種物質(均為氣態)間進行反應,其物質的量隨時間的變化曲線如圖。據圖回答:
(1)該反應的化學方程式可表示為。
(2)反應起始至tmin(設t=5),Z的平均反應速率是,X的轉化率為(用百分數表示),Y的體積分數為
(3)下列可判斷反應已達到平衡狀態的是。
A.X、Y、Z的反應速率相等
B.體系的壓強保持不變
C.混合氣體的密度不變
D.生成1molZ的同時生成2molX
E.混合氣體的平均分子質量不變
(4)一定能使該反應的反應速率增大的措施有。
A.其他條件不變,及時分離出產物
B.適當降低溫度
C.其他條件不變,增大X的濃度
D.保持溫度不變,將容器體積壓縮為1L
E.恒容條件下沖入氦氣,使壓強增大組卷:12引用:3難度:0.6


