2022年北京大學附中高考化學三模試卷
發布:2024/11/2 17:30:1
一、本部分共14題,每題3分,共42分。在每題列出的四個選項中,選出最符合題目要求的一項。
-
1.
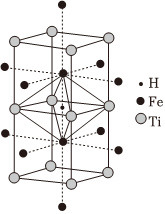 鈦鐵基儲氫合金是由鈦、鐵兩種元素組成的金屬間化合物。該合金吸收氫氣后的晶胞如圖所示,每個氫被4個鈦原子和2個鐵原子包圍。下列說法不正確的是( )
鈦鐵基儲氫合金是由鈦、鐵兩種元素組成的金屬間化合物。該合金吸收氫氣后的晶胞如圖所示,每個氫被4個鈦原子和2個鐵原子包圍。下列說法不正確的是( )A.鈦鐵合金屬于金屬晶體,主要作用力為金屬鍵 B.未吸收氫氣時,鈦鐵合金的晶胞示意圖為: 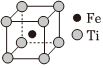
C.鈦鐵合金中每個Ti周圍距離最近且等距的Fe有8個 D.圖中形成的金屬氫化物的化學式:TiFeH2 組卷:112引用:3難度:0.4 -
2.下列化學用語正確的是( )
A.二氧化碳的電子式: 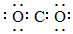
B.乙醛的空間填充模型: 
C.基態Mn2+的價電子軌道表示式: 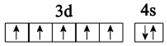
D.反式聚異戊二烯的結構簡式: 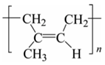 組卷:97引用:8難度:0.7
組卷:97引用:8難度:0.7 -
3.下列各項比較中,一定相等的是( )
A.相同質量的苯和乙炔所含的碳原子的數目 B.相同質量的 H2O和11H2O所含的原子數31C.標準狀況下的2.24LHCl氣體和1L0.1mol?L-1鹽酸中所含Cl-的數目 D.相同pH的H2SO4和NaHSO4溶液中SO42-的濃度 組卷:88引用:1難度:0.7 -
4.下列事實不是氫鍵導致的是( )
A.CH3CH2OH的沸點(78.5℃)顯著高于CH3OCH3的沸點(-29.5℃) B.對羥基苯甲醛(  )的熔點(115℃)顯著高于鄰羥基苯甲醛(
)的熔點(115℃)顯著高于鄰羥基苯甲醛( )的熔點(2℃)
)的熔點(2℃)C.NH3的水溶性顯著高于PH3 D.H2O的熱穩定性顯著高于H2S 組卷:119引用:1難度:0.6 -
5.下列實驗方案能達到相應實驗目的的是( )
實驗目的 實驗方案 A 證明銅與濃硫酸反應生成了SO2 將銅單質與濃硫酸在試管中加熱,產生的氣體通入石蕊溶液,觀察石蕊是否變紅 B 檢驗濃硫酸催化纖維素水解的產物含有還原性糖 向水解后的溶液中加入新制Cu(OH)2濁液,加熱,觀察是否有磚紅色沉淀生成 C 檢驗Na2SO3是否變質 向Na2SO3溶液中加入Ba(NO3)2和稀硝酸,觀察是否產生白色沉淀 D 證明1-溴丁烷發生了消去反應 將1-溴丁烷與NaOH醇溶液共熱,將產生的氣體通入溴水,觀察溴水是否褪色 A.A B.B C.C D.D 組卷:40引用:1難度:0.5 -
6.下列解釋事實的方程式不正確的是( )
A.84消毒液(主要成分為NaClO)中加入少量白醋可增強消毒效果:ClO-+CH3COOH═HClO+CH3COO- B.用Na2CO3將水垢中的CaSO4轉化為易于除去的CaCO3:CaSO4+CO32-═CaCO3+SO42- C.將少量Ba(OH)2溶液加入NaHSO4溶液中:Ba2++OH-+H++SO42-═BaSO4↓+H2O D.用Na2S2O3做碘量法實驗時,溶液pH不可太低,否則溶液變渾濁:S2O32-+2H+═SO2↑+S↓+H2O 組卷:89引用:1難度:0.7
二、本部分共5題,共58分。
-
18.化合物M是橋環化合物二環[2.2.2]辛烷的衍生物,其合成路線如圖:

已知:ⅰ.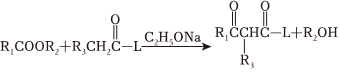 (L=OR4或..
(L=OR4或..
ⅱ.
(ⅰ、ⅱ中R1、R2、R3、R4均代表烴基)
(1)A可與NaHCO3溶液反應,其名稱為。B中所含官能團為
(2)B→C的化學方程式為。
(3)試劑a的分子式為C5H8O2,能使Br2的CCl4溶液褪色,則C→D的反應類型為。
(4)F→G的化學反應方程式為。
(5)已知E→F和J→K都發生了相同的反應,則帶六元環結構的K的結構簡式為。
(6)HOCH2CH2OH的作用是保護G中的酮羰基,若不加以保護,則G直接在C2H5ONa作用下可能得到I之外的副產物,請寫出一個帶六元環結構的副產物的結構簡式。
(7)已知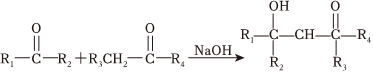 。由K在NaOH作用下反應得到化合物M,該物質具有如圖所示的二環[2.2.2]辛烷的立體結構,請在圖中補充必要的官能團得到完整的M的結構簡式 。
。由K在NaOH作用下反應得到化合物M,該物質具有如圖所示的二環[2.2.2]辛烷的立體結構,請在圖中補充必要的官能團得到完整的M的結構簡式 。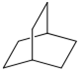 組卷:38引用:1難度:0.3
組卷:38引用:1難度:0.3 -
19.實驗室探究NaHSO3溶液與Cu2+的反應.
Ⅰ.如圖所示制備NaHSO3(經檢驗裝置氣密性良好).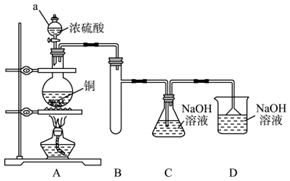
(1)儀器a的名稱是.
(2)寫出C中制備NaHSO3的離子方程式.
Ⅱ.探究NaHSO3溶液與Cu2+的反應,過程如圖所示: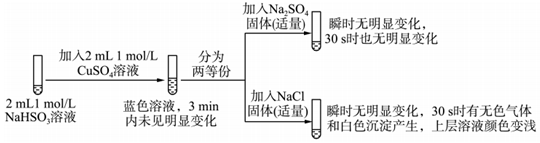
已知:硫酸亞銅易溶于水.
回答下列問題:
(3)加入NaCl固體后產生的無色氣體經檢驗為SO2,寫出該檢驗的實驗操作及現象:.(可選試劑:0.1mol/LNaOH溶液、0.1mol/LKMnO溶液、碘水)
(4)加入NaCl固體后產生的白色沉淀經檢驗是CuCl,說明發生了氧化還原反應.加入NaCl固體發生反應的原因:
a.Cl-改變了HSO3-的還原性
b.Cl-改變了的Cu2+的氧化性
用原電池原理進行實驗,探究上述可能的原因.
①由實驗1、2可知原因a不合理,依據是編號 實驗1 實驗2 實驗 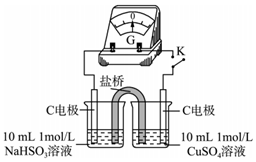
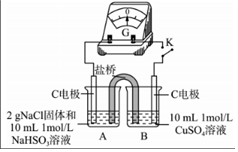
現象 閉合開關K,電流計指針發生微小偏轉,燒杯中未見明顯現象 閉合開關K,電流計指針發生微小偏轉,燒杯中未見明顯現象 .
②實驗3:用如圖所示裝置實驗,B中有白色沉淀生成,證明原因b合理.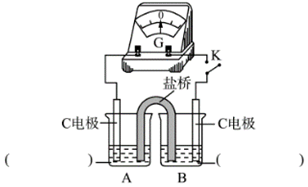
ⅰ.補全電化學裝置示意圖.
ⅱ.寫出B中的電極反應方程式.
ⅲ.請從反應原理的角度解釋原因:Cl-與Cu2+的還原產物Cu+形成沉淀,,使HSO3-與Cu2+的反應能夠進行完全.
Ⅲ.金能與濃硝酸發生微弱反應生成Au3+,短時間幾乎觀察不到金溶解.金易溶于“王水”[V(濃硝酸):V(濃鹽酸)=1:3].已知:Au3++4Cl-+H+?HAuCl4
(5)利用(4)中實驗探究的結論,分析“王水”溶金的原理:.組卷:81引用:3難度:0.5


