2020-2021學年湖北省名校聯盟高三(下)開學化學試卷
發布:2024/12/8 1:30:2
一、選擇題:本題共15小題,每小題3分,共45分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.化學與生活密切相關,下列有關說法錯誤的是( )
A.現代化建設要使用大量鋼材,鋼材是用途廣泛的合金 B.二氧化硫除具有漂白性外,還可用于殺菌、消毒 C.能消殺病毒的過氧乙酸,具有強氧化性、弱酸性等性質,是強電解質 D.在海輪外殼上鑲入活潑金屬,可減緩船體的腐蝕速率 組卷:115引用:5難度:0.8 -
2.1934年約里奧?居里夫婦在核反應中用α粒子(即氦核
He)轟擊金屬原子42X,得到核素WZY,開創了人造放射性核素的先河:30Z+2X+WZHe→42Y+30Z+2n其中元素X、Y的最外層電子數之和為8.下列敘述正確的是( )10A. X的相對原子質量為26WZB.X、Y均可形成三氯化物 C.X的原子半徑小于Y的 D.Y僅有一種含氧酸 組卷:1286引用:15難度:0.5 -
3.設NA為阿伏加德羅常數的值,下列說法不正確的是( )
A.28g乙烯和環丁烷的混合氣體中含有的碳原子數為2NA B.常溫下,5.6g Fe與含0.2mol HNO3的溶液充分作用,最少失去的電子數為0.15NA C.2.0g D2O中含有的質子數、電子數均為NA D.含1mol Cl-的NH4Cl溶液中加入適量氨水使溶液呈中性,此時溶液中NH4+數為NA 組卷:14引用:1難度:0.5 -
4.用來解釋下列事實的方程式不正確的是( )
A.鋼鐵發生吸氧腐蝕的正極反應:O2+4e-+2H2O═4OH- B.將氯氣通入石灰乳制備漂白粉:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O C.向Na2SiO3溶液中通過量CO2制備硅酸凝膠:SiO32-+2CO2+2H2O═H2SiO3+2HCO3- D.溶質物質的量比為1:1的明礬溶液和Ba(OH)2溶液混合:2SO42-+2Ba2++Al3++4OH-═AlO2-+2BaSO4↓+2H2O 組卷:31引用:7難度:0.7 -
5.W、X、Y、Z是同周期主族元素,Y的最外層電子數是X次外層電子數的3倍,四種元素與鋰組成的鹽是一種新型電池的電解質結構如圖。下列說法不正確的是( )
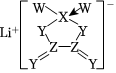
A.非金屬性:W>Y>Z>X B.Y、Z組成的分子可能為非極性分子也可能為極性分子 C.W是同周期中原子半徑最大的元素 D.陰離子中所有原子均滿足8電子穩定結構 組卷:58引用:7難度:0.5 -
6.R.F.Heck、Ei-ichiNegishi和AkiraSuzuk三名科學家因在鈀(Pd)催化交叉偶聯反應方面的卓越研究獲得2010年諾貝爾化學獎,其中Heck反應的歷程如圖,下列說法錯誤的是( )

A.Heck反應的總反應類型為取代反應 B. 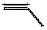 中最多有6個原子共平面
中最多有6個原子共平面C. 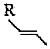 可使溴水或酸性KMnO4溶液褪色
可使溴水或酸性KMnO4溶液褪色D.若RX為CH3CH2Br,則 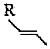 的同類別同分異構體還有4種(不考慮立體異構)組卷:7引用:2難度:0.5
的同類別同分異構體還有4種(不考慮立體異構)組卷:7引用:2難度:0.5
二、非選擇題:本題共4小題,共55分。
-
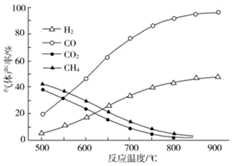 18.乙酸制氫具有重要意義:
18.乙酸制氫具有重要意義:
熱裂解反應:CH3COOH(g)═2CO(g)+2H2(g)ΔH=+213.7kJ?mol-1
脫羧基反應:CH3COOH(g)═CH4(g)+CO2(g)ΔH=-33.5kJ?mol-1
(1)2CO(g)+2H2(g)═CH4(g)+CO2(g)ΔH=kJ?mol-1。
(2)在密閉容器中,利用乙酸制氫,選擇的壓強為(填“高壓”或“常壓”)。其中溫度與氣體產率的關系如圖。
①約650℃之前,脫羧基反應活化能低,反應速率快,很快達到平衡,故氫氣產率低于甲烷;650℃之后氫氣產率高于甲烷,理由是。
②保持其他條件不變,在乙酸氣中摻雜一定量的水,氫氣產率顯著提高而CO的產率下降,請用化學方程式表示。
(3)保持溫度為T℃,壓強為pkPa不變的條件下,在密閉容器中投入一定量的醋酸發生上述兩個反應,達到平衡時熱裂解反應消耗乙酸20%,脫羧基反應消耗乙酸60%,則平衡時乙酸體積分數為(結果保留1位小數);脫羧基反應的平衡常數Kp為kPa。(結果保留1位小數)
(4)光催化反應技術使用CH4和(填化學式)直接合成乙酸,且符合“綠色化學”的要求。(原子利用率100%)
(5)若室溫下將amol/L的CH3COOH溶液和bmol/LBa(OH)2溶液等體積混合,恢復室溫后有2c(Ba2+)=c(CH3COO-),則乙酸的電離平衡常數Ka=。(用含a和b的代數式表示)組卷:91引用:3難度:0.4 -
19.釩具有廣泛用途。黏土釩礦中,釩以+3、+4、+5價的化合物存在,還包括鉀、鎂的鋁硅酸鹽,以及SiO2、Fe3O4。采用以下工藝流程可由黏土釩礦制備NH4VO3。
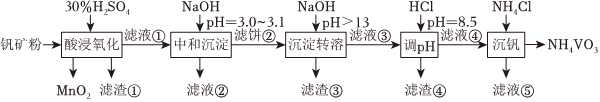
該工藝條件下,溶液中金屬離子開始沉淀和完全沉淀的pH如表所示。
回答下列問題:金屬離子 Fe3+ Fe2+ Al3+ Mn2+ 開始沉淀pH 1.9 7.0 3.0 8.1 完全沉淀pH 3.2 9.0 4.7 10.1
(1)“酸浸氧化”需要加熱,其原因是。
(2)“酸浸氧化”中,VO+和VO2+被氧化成,同時還有VO+2離子被氧化。寫出VO+轉化為反應的離子方程式VO+2。
(3)“中和沉淀”中,釩水解并沉淀為V2O5?xH2O,隨濾液②可除去金屬離子K+、Mg2+、Na+、,以及部分的。
(4)“沉淀轉溶”中,V2O5?xH2O轉化為釩酸鹽溶解。濾渣③的主要成分是。
(5)“調pH”中有沉淀生產,生成沉淀反應的化學方程式是。
(6)“沉釩”中析出NH4VO3晶體時,需要加入過量NH4Cl,其原因是。組卷:102引用:3難度:0.5


