2021-2022學年浙江省9+1高中聯盟高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本大題共25小題,每小題2分,共50分。每個小題列出的四個備選項中只有一個是符合題目要求的,不選、多選、錯選均不得分)
-
1.下列屬于非電解質的是( )
A.H2O B.硝酸鉀 C.HCl D.SO2 組卷:2引用:1難度:0.8 -
2.配制0.1 mol/L的硫酸需用到的儀器是( )
A. 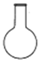
B. 
C. 
D. 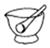 組卷:0引用:1難度:0.6
組卷:0引用:1難度:0.6 -
3.下列有關化學用語正確的是( )
A.用電子式表示氧化鈉的形成過程: 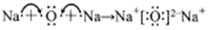
B.乙酸乙酯的結構簡式:C4H8O2 C.18O原子結構示意圖: 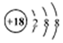
D.NaHCO3在水中電離:NaHCO3?Na++HCO3- 組卷:5引用:1難度:0.7 -
4.我國古代四大發明之一的黑火藥爆炸時反應的化學方程式為:S+2KNO3+3C
K2S+N2↑+3CO2↑。關于該反應說法正確的是( )點燃A.S在反應中失去電子 B.C在反應中得到電子 C.氧化劑與還原劑物質的量之比為2:3 D.氧化產物與還原產物物質的量之比為3:2 組卷:4引用:3難度:0.8 -
5.安全是開展實驗探究的首要原則。下列有關實驗安全的說法中不正確的是( )
A.輕微燙傷或燒傷時,可先用潔凈的冷水處理,降低局部溫度,然后涂上燙傷膏藥 B.未用完的金屬鈉不能放回原試劑瓶,可投入水槽中與水反應進行處理 C.銅與濃硫酸反應完畢,可將反應液倒入盛水的燒杯中觀察產物溶液的顏色 D.進行化學實驗時佩戴護目鏡,可防止化學試劑飛濺進入眼睛 組卷:14引用:2難度:0.8 -
6.2021年9月24日《Science》報道,中國科學家在實驗室通過11步化學反應實現了以CO2和H2O為主要原料合成淀粉。下列有關說法不正確的是( )
A.該技術可能有助于解決人類糧食短缺問題 B.將CO2轉化為營養物質,有助于盡早實現碳中和(CO2的排放總量與減少總量相當) C.該淀粉可水解生成葡萄糖,葡萄糖經緩慢氧化轉變為CO2,并釋放能量 D.化學實驗中常用KI溶液檢測淀粉的存在 組卷:2引用:1難度:0.7 -
7.化學與人類生活、社會可持續發展密切相關,下列說法不正確的是( )
A.氫氧化鐵膠體具有良好的吸附性,可用于飲用水的凈化 B.高純硅是一種重要的信息材料,利用其導光性能生產光導纖維 C.漂粉精既可作棉、麻、紙張的漂白劑,又可用作泳池及環境的消毒劑 D.漢代燒制出“明如鏡、聲如磬”的瓷器,其主要原料為黏土 組卷:6引用:2難度:0.7 -
8.下列說法正確的是( )
A.石油分餾和煤的干餾都是物理變化 B.非處方藥的包裝上有OTC標識 C.NaNO2具有一定毒性,不可作為食品添加劑 D.尼龍繩、羊絨衫和棉襯衣等生活用品都是由合成纖維制造的 組卷:3引用:1難度:0.6 -
9.下列說法正確的是( )
A.油脂與乙酸乙酯均可發生水解反應 B.蛋白質都易溶于水,可水解為氨基酸 C.攝入人體的纖維素在人體中酶的催化作用下逐步水解,最終生成葡萄糖 D.CH3CH3與Cl2反應制備CH3CH2Cl,符合原子經濟性要求 組卷:7引用:1難度:0.6 -
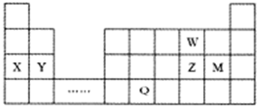 10.W、X、Y、Z、M、Q六種主族元素,它們在周期表中位置如圖所示,下列說法正確的是( )
10.W、X、Y、Z、M、Q六種主族元素,它們在周期表中位置如圖所示,下列說法正確的是( )A.簡單離子的半徑大小:X+>Y2+>W2- B.Z的某種氧化物能使酸性高錳酸鉀溶液褪色,體現了該氧化物的漂白性 C.Z、M形成的化合物Z2M2中只存在極性共價鍵 D.元素Q位于金屬與非金屬的分界線附近,推測Q元素的單質可用作半導體材料 組卷:5引用:1難度:0.5
二、非選擇題(本大題共5小題,共50分)
-
29.某化學興趣小組在實驗室中模擬并改進侯氏制堿法制備NaHCO3,進一步處理得到產品Na2CO3和NH4Cl,實驗流程如圖:
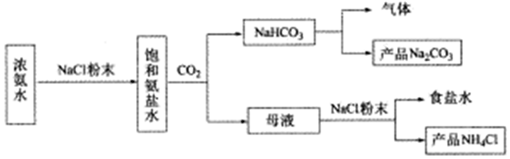
回答下列問題:
(1)從A~E中選擇合適的儀器制備NaHCO3,正確的連接順序是a→→→→→g,其中D裝置中發生反應的化學方程式是。
A.
B.
C.
D.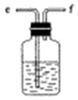
E.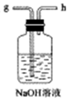
(2)B中使用霧化裝置的優點是。
(3)上述流程中,先將NaCl粉末加入濃氨水中,再通入CO2,而不是向飽和食鹽水中先通入CO2,再加濃氨水,從平衡移動的角度解釋這樣操作的優點。
(4)母液加入NaCl粉末,經蒸發濃縮、冷卻結晶,可析出NH4Cl晶體的原因是。
(5)無水NaHCO3可作為基準物質,精確稱取后配成濃度準確的溶液,用于標定鹽酸濃度。若無水NaHCO3保存不當,部分受熱發生了分解,以甲基橙為指示劑,用其配制的溶液標定鹽酸濃度時,會使標定結果。
A.偏高
B.偏低
C.不變
D.無法判斷組卷:5引用:1難度:0.7 -
30.探究硫及其化合物的轉化,有重要的現實意義。
(1)一定溫度下,恒壓密閉容器中發生反應2SO2 (g)+O2(g)?2SO3(g),下列說法正確的是。
A.使用合適的催化劑,可改變反應途徑,加快反應速率
B.通入含有18O的O2,平衡時只有O2、SO3中含有18O
C.反應達到平衡后,再次通入適量O2,平衡正向移動
D.充入適量惰性氣體,有助于提高原料的利用率
(2)精制爐氣各組分的體積分數SO2為a%、O2為b%(b=0.5a),N2為c%。選擇五氧化二釩(V2O5)作催化劑合成SO3,SO2的平衡轉化率與反應溫度和壓強的關系如圖1所示。
①催化反應過程中V2O5與V2O4相互轉化,寫出生成SO3這一步的反應方程式。
②實際生產選擇圖中A點的反應條件,不選擇B、C點理由分別是。
③計算,D點SO3的分壓是Mpa(用含有a的代數式表示,分壓=總壓×該組分的體積分數)。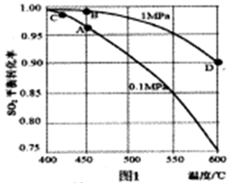
(3)煤炭燃燒采用鈣基固硫技術可減少SO2排放,但煤炭燃燒過程中產生的CO又會與CaSO4發生化學反應,降低了脫硫效率。相關反應的熱化學方程式如下:
反應ⅠCaSO4(s)+CO(g)?CaO(s)+SO2(g)+CO2(g)△H1=218.4kJ?mol-1
反應ⅡCaSO4(s)+4CO(g)?CaS(s)+4CO2(g)△H2=-175.6kJ?mol-1
某溫度下,若反應Ⅰ的速率遠大于反應Ⅱ,請在圖2中畫出反應Ⅱ的過程能量變化示意圖(假定初始狀態能量相同)。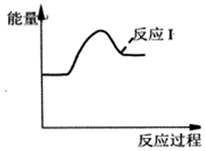
(4)工業上一般選用濃硫酸吸收SO3,得到一種液態物質X,取5.16gX與足量Ba(OH)2溶液反應僅生成13.98g難溶性鹽(白色沉淀)和水,則液態物質X的化學式為。組卷:4引用:1難度:0.7


