2021-2022學年遼寧省遼東南協作體高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每題只有一個答案正確,每題3分,共45分)
-
1.中國首條“生態馬路”在上海復興路隧道建成,它運用了“光觸媒”技術,在路面涂上一種光催化劑涂料,可將汽車尾氣中45%的NO和CO轉化成N2和CO2 :2NO+2CO?N2+2CO2 △H<0下列對此反應的敘述中正確的是( )
A.降低溫度能使v(正)增大,v(逆)減小,平衡正向移動,提高反應物的轉化率 B.增大壓強能使該反應的化學平衡常數K增大 C.使用光催化劑能增大NO的轉化率 D.使用光催化劑能增大活化分子的百分數 組卷:102引用:12難度:0.5 -
2.下列應用與鹽類水解無主要關系的是( )
A.用鋁鹽和鐵鹽作凈水劑 B.實驗室盛放Na2CO3溶液的試劑瓶不能用磨口玻璃塞 C.FeSO4溶液制備FeSO4?7H2O晶體時,不能直接蒸干結晶獲取 D.Al2S3不能通過溶液中的反應制取 組卷:39引用:1難度:0.7 -
3.設NA為阿伏加德羅常數的值,下列敘述正確的是( )
A.密閉容器中,1mol N2和3mol H2充分催化反應后分子總數為2NA B.1L0.1mol?L-1NH4Cl溶液中,NH4+的數量為0.1NA C.1molNa與足量O2反應生成Na2O和Na2O2的混合物,轉移的電子數為NA D.25℃時,1L pH=13的Ba(OH)2溶液中,含有的OH-數目為0.2NA 組卷:20引用:4難度:0.5 -
4.下列能用勒夏特列原理解釋的是( )
A.Fe(SCN)3溶液中加入固體KSCN后顏色變深 B.工業合成氨在500℃時進行 C.H2、I2、HI平衡混合氣體加壓后顏色變深 D.SO2制SO3的反應要使用催化劑 組卷:20引用:2難度:0.6 -
 5.實驗室測定中和熱的實驗裝置如圖所示,下列有關說法正確的是( )
5.實驗室測定中和熱的實驗裝置如圖所示,下列有關說法正確的是( )A.燒杯間填滿碎泡沫塑料的作用是固定小燒杯 B.缺少的儀器是環形鐵質攪拌棒 C.測酸液溫度后的溫度計要用水清洗后再測堿液的溫度 D.向盛裝酸的燒杯中加堿時要小心緩慢 組卷:36引用:5難度:0.7 -
6.下列說法不正確的是( )
A.1mol鈉蒸氣與2mol鈉蒸氣完全燃燒時,燃燒熱相同 B.燃燒熱是反應熱的種類之一 C.在稀溶液中:H+(aq)+OH-(aq)═H2O(l)ΔH=-57.3kJ?mol-1,若將含1molHNO3的稀溶液與含1molBa(OH)2的稀溶液混合,放出的熱量為57.3kJ D.在101kPa25℃時,2gH2完全燃燒生成液態水,放出285.8kJ熱量,氫氣燃燒的熱化學方程式表示為2H2(g)+O2(g)═2H2O(l)ΔH=+285.8kJ?mol-1 組卷:10引用:1難度:0.7
二、填空題(共四道大題,共55分)
-
18.亞硝酰氯(NOCl)是有機合成中的重要試劑,可由NO和Cl2反應得到,化學方程式為2NO(g)+Cl2(g)?2NOC1(g).
(1)氨氧化物與懸浮在大氣中的海鹽粒子相互作用時會生成亞硝酸氫,涉及如下反應
①2NO2(g)+NaCl(s)?NaNO3(s)+NOCl(g)
②4NO2(g)+2NaCl(s)?2NaNO3 (s)+2NO(g)+Cl2(g)
③2NO(g)+Cl2(g)?2NOCl(g)
設反應①②③對應的平衡常數依次為K1、K2、K3,則K1、K2、K3之間的關系為.
(2)在1L恒容密閉容器中充入2molNO(g)和1molCl2(g),在不同溫度下得c(NOCl)與時間t的關系如圖A所示: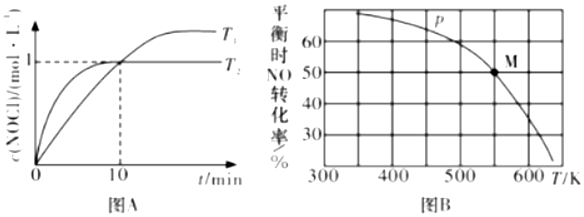
①反應開始到10min時NO的平均反應速率v(NO)=mol?L-1?min.
②T2溫度下反應的平衡常數K為.
③T2溫度下Cl2的平衡轉化率為.
(3)若按料比n(NO):n(Cl2)=2:1把NO和Cl2加入到一恒壓的密容中發生反應,平衡時NO的轉化率與溫度T,壓強p(總壓)的關系如圖B所示。
①該反應的ΔH(填“>”“<”或“=”)0.
②在p壓強條件下,M點對應溫度下,達到平使時容器內NO的體積分數為.
⑤若反應一直保持在p壓強條件下進行,則M點的分壓平衡常數Kp=(用含p的表達式表示,用平衡分壓代替平衡濃度計算,分壓=總壓體×積分數).組卷:5引用:1難度:0.5 -
19.常溫下有濃度均為0.1mol?L-1的四種溶液:
①Na2CO3
②NaHCO3
③HCl
④NH3?H2O
(1)有人稱溶液①是油污的“清道夫”,原因是(用離子方程式解釋).
(2)這四種溶液中水的電離程度由大到小的順序是(用序號填寫).
(3)向④中加入少量氯化銨固體.此時的值c(OH-)c(NH3?H2O)(填“增大”“減小”或“不變”).
(4)將10mL溶液加水稀釋至100mL,則此時溶液中由水電離出的c(H+)=mol?L-1.
(5)在化學分析中采用K2CrO4為指示劑,以AgNO3標準溶液滴定溶液中的Cl-,利用Ag+與CrO42-生成磚紅色沉淀,指示到達滴定終點,當溶液中Cl-恰好完全沉淀(濃度等于1.0×10-5mol?L-1)時,溶液中c(Ag+)為mol?L-1,此時液中c(CrO42-)等于mol?L-1.(已知Ag2CrO4、AgCl的Ksp分別為2.0×10-12和2.0×10-10).
(6)+6價鉻的化合物毒性較大,常用NaHSO3將廢液中的Cr2O72-還原成Cr3+.反應的離子方程式為.組卷:9引用:1難度:0.7


