2020-2021學年安徽省合肥市新東方學校高二(下)月考化學試卷(1)0019
發布:2025/1/6 6:30:3
一、選擇題:本題共16小題,每小題3分,共48分。在每小題給出的四個洗項中,只有一項是符合題目要求的。
-
1.下列說法正確的是( )
A.利用84消毒液的堿性對環境殺菌消毒 B.制作醫用口罩的聚丙烯能發生加成反應 C.蛋白質在硫酸銨溶液中發生變性 D.甘油醛(HOCH2CHOHCHO)分子中含手性碳原子 組卷:5引用:2難度:0.7 -
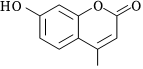 2.某有機物R的結構簡式如圖所示。常溫下,R與下列溶液反應沒有明顯顏色變化的是( )
2.某有機物R的結構簡式如圖所示。常溫下,R與下列溶液反應沒有明顯顏色變化的是( )A.NaOH溶液 B.溴水 C.FeCl3溶液 D.酸性KMnO4溶液 組卷:16引用:3難度:0.5 -
3.《本草綱目》中“石堿”條目下寫道:“采蒿蓼之屬,曬干燒灰,以水淋汁,久則凝淀如石,浣衣發面,亦去垢發面。”“石堿”的主要成分是K2CO3。下列說法錯誤的是( )
A.石堿溶液中:c(K+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) B.石堿溶液中:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) C.熱石堿溶液除油污的原理是油脂直接與K2CO3反應 D.石堿溶液與銨鹽溶液混合可能產生氣體 組卷:42引用:2難度:0.6 -
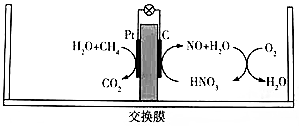 4.研究發現,在酸性天然氣燃料電池中加入硝酸,可持續大電流放電,其工作原理如圖所示,下列說法錯誤的是( )
4.研究發現,在酸性天然氣燃料電池中加入硝酸,可持續大電流放電,其工作原理如圖所示,下列說法錯誤的是( )A.交換膜為質子交換膜 B.加入硝酸改變了負極反應歷程 C.正極區總反應為O2+4e-+4H+═2H2O D.1molCH4完全反應時轉移8mol電子 組卷:20引用:2難度:0.7 -
5.我國科學家首次利用LiH-3d過渡金屬復合催化劑合成氨。已知熱化學方程式:
①3LiH(s)+N2(g)═Li2NH(s)+LiNH2(s)△H1=+32.8kJ?mol-1
②Li2NH(s)+2H2(g)═2LiH(s)+NH3(g)ΔH2=-78.0kJ?mol-1
③LiNH2(s)+H2(g)═LiH(s)+NH3(g)ΔH3
④N2(g)+3H2(g)?2NH3(g)ΔH4=-92.4kJ?mol-1
下列有關說法錯誤的是( )A.向容器中加入1molN2和3molH2,充分反應放出92.4kJ熱量 B.反應④的平衡常數表達式K= c2(NH3)c(N2)?c3(H2)C.反應③的ΔH3=-47.2kJ?mol-1 D.上述反應中,正反應活化能大于逆反應活化能的是① 組卷:23引用:2難度:0.7 -
6.SO2對N2O的催化分解具有促進作用,其原理如下:
Ⅰ.N2O+★→N2+O★(快反應)
Ⅱ.SO2+O★→SO3+★(快反應)
Ⅲ.N2O+★→N2+O2+★(慢反應)
下列有關說法正確的是( )A.SO2的還原性比N2O弱 B.反應Ⅰ對N2O的催化分解速率起決定作用 C.反應Ⅲ的活化能比反應Ⅰ或反應Ⅱ的大 D.催化劑能提高N2O的催化分解速率和平衡轉化率 組卷:9引用:2難度:0.5 -
7.肉桂醇在一定條件下可轉化成肉桂醛,分子的球棍模型如圖所示。下列說法錯誤的是( )
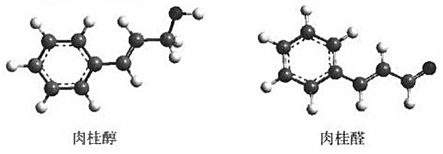
A.肉桂醇和肉桂醛都能發生加聚反應 B.用酸性KMnO4溶液可檢驗肉桂醇和肉桂醛 C.肉桂醛分子中所有原子可能共平面 D.肉桂醛與 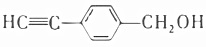 互為同分異構體組卷:16引用:3難度:0.5
互為同分異構體組卷:16引用:3難度:0.5
二、非選擇題:本題共5小題,共52分。
-
20.E是一種中草藥的有效成分,其某種合成路線如下(部分條件和產物省略):
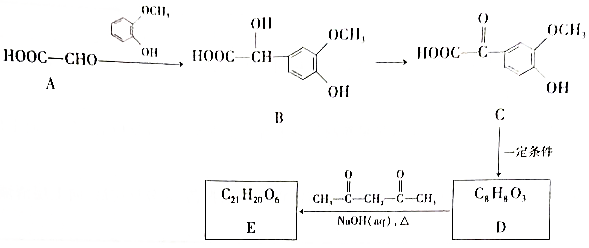
①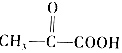 一定條件
一定條件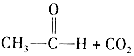
②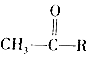 +CH3CHONaOH(aq)
+CH3CHONaOH(aq)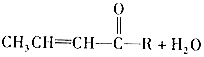
③2RCH═CHR1一定條件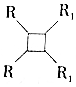
回答下列問題:
(1)C中含不飽和鍵的官能團的名稱是。
(2)A→B的反應類型是。
(3)E的結構簡式為。
(4)D的同分異構體中,符合下列條件的結構有種(不考慮立體異構)。
ⅰ.遇氯化鐵溶液發生顯色反應;ⅱ.能發生水解反應;ⅲ.1mol該物質與燒堿溶液反應,最多消耗3molNaOH。
寫出其中一種苯環上的核磁共振氫譜只有兩組峰的物質的結構簡式:。
(5)參照上述信息,寫出由乙醛制備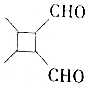 的合成路線:(無機試劑任選)。組卷:9引用:2難度:0.4
的合成路線:(無機試劑任選)。組卷:9引用:2難度:0.4 -
21.釩及其化合物在生產、生活中有廣泛應用。
Ⅰ.作二次電池材料。全釩液流儲能二次電池的原理如圖1所示(M、N都是惰性電極),充電過程中,交換膜右室溶液的藍色逐漸變為深綠色。
已知幾種離子的顏色如下:
(1)放電過程中,N極的電極反應式為離子 V3+ V2+ VO2+ VO+2顏色 綠色 紫色 藍色 淺黃色或深綠色 ,電路中每轉移amol電子,理論上有mol H+由交換膜左側向右側遷移。
(2)充電過程中,M極發生反應(填“氧化”或“還原”)。
(3)該電池中,100mL0.1mol?L-1V2+溶液中V2+完全被氧化時,產生的電量為庫侖(C)(1mol電子的電量為96500C)。
(4)已知E池為電池電動勢[電池電動勢即電池的理論電壓,是兩個電極電勢之差,E池=E(+)-E(-)],△G為電池反應的自由能變化,△G=-zFE池(z為電池反應的電荷數,F為法拉第常數)。E值越大,氧化態物質的氧化性越強。根據上述信息判斷,E()VO+2VO2+E()(填“>”“<”或“=”,下同),上述電池反應中,△GV3+V2+0。
Ⅱ.作催化劑。V2O5常用作工業接觸法制硫酸的催化劑,SO2轉化為SO3的反應歷程與能量的關系如圖2所示。
(5)下列有關V2O5的說法正確的是(填字母)。
A.曲線Ⅱ代表加入V2O5,曲線Ⅰ代表未加入V2O5
B.V2O5的作用是降低過渡態的相對能量
C.V2O5能提高活化分子百分率
D.V2O5可加快反應速率、改變焓變和平衡常數
(6)向某恒容密閉容器中充入2mol SO2(g)和1mol O2(g),發生反應:2SO2(g)+O2(g)?2SO3(g),在一定溫度下達到平衡時SO3的體積分數為40%,氣體總壓強為5aMPa。該溫度下,上述反應的平衡常數Kp=MPa-1(用含a的代數式表示,Kp是用分壓表示的平衡常數,分壓=總壓×物質的量分數)。組卷:29引用:2難度:0.5


