2020-2021學年貴州省貴陽市普通高中高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一.選擇題(16小題,每題3分,共48分。每題只有一個選項最符合題意,請將正確選項的序號填入答題卡相應的位置)。
-
1.化學與生產、生活密切相關。下列說法正確的是( )
A.明礬可用于自來水的殺菌消毒 B.將AlCl3溶液加熱蒸干可制取無水AlCl3 C.船身上裝鋅塊避免船體受腐蝕是利用了原電池原理 D.泡沫滅火器可用于一般的滅火,也適用于電器滅火 組卷:8引用:3難度:0.5 -
2.下列物質能促進水的電離,且水溶液呈堿性的是( )
A.NaHSO4 B.Na2SiO3 C.NH3?H2O D.NH4Cl 組卷:11引用:1難度:0.7 -
3.常溫時,下列事實不能說明醋酸屬于弱電解質的是( )
A.醋酸水溶液中c(H+)>c(CH3COO-) B.0.01mol?L-1醋酸溶液的pH大于2 C.0.1mol?L-1CH3COONa溶液顯堿性 D.pH=3的醋酸溶液加水稀釋10倍后,pH<4 組卷:6引用:2難度:0.7 -
4.理論研究表明,在101kPa和298K下,HCN(g)?HNC(g)異構化反應過程的能量變化如圖所示。下列說法錯誤的是( )
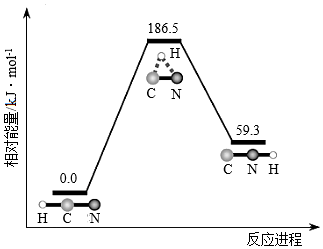
A.HCN比HNC穩定 B.該異構化反應的ΔH=+59.3kJ?mol-1 C.正反應的活化能大于逆反應的活化能 D.使用催化劑,可以改變反應的反應熱 組卷:1057引用:29難度:0.6 -
5.下列熱化學方程式正確的是( )
A.2SO2+O2?2SO3;△H=-196.6 kJ?mol-1 B.H2 (g)+ O2 (g)=H2O(l);△H=-285.8 kJ?mol-112C.2H2 (g)+O2 (g)=2H2O(l);△H=-571.6 kJ D.C(s)+O2 (g)=CO2 (g);△H=+393.5 kJ?mol-1 組卷:23引用:4難度:0.9 -
6.反應C(s)+H2O(g)
CO(g)+H2(g)在一體積可變的密閉容器中進行。改變下列條件對提高化學反應速率比較明顯的是( )高溫
①增大C的用量;
②將容器體積縮小一半;
③保持壓強不變,充入N2使容器體積增大;
④保持體積不變,充入更多水蒸氣。A.①③ B.①④ C.②④ D.②③④ 組卷:5引用:1難度:0.6 -
7.已知反應FeO(s)+C(s)=CO(g)+Fe(s)ΔH>0,該反應自發進行的條件是( )
A.高溫自發 B.低溫自發 C.一定非自發 D.任意溫度下都能自發進行 組卷:5引用:1難度:0.7
二.第II卷(非選擇題共52分)
-
20.我國在西昌衛星發射“長征三號甲”是三級液體助推火箭,一、二級為常規燃料,常規燃料通常指以肼(N2H4)為燃料,以二氧化氮作氧化劑。
I.有人認為若用氟氣代替二氧化氮作氧化劑,反應釋放的能量更大。
(1)已知:N2H4(g)+O2(g)=N2(g)+2H2O(g)ΔH1=-543kJ?mol-1
H2(g)+F2(g)=2HF(g)ΔH2=-538kJ?mol-1
2H2(g)+O2(g)=2H2O(g)ΔH3=-484kJ?mol-1
則:N2H4(g)+2F2(g)=N2(g)+4HF(g)ΔH4=。
II.氧化劑二氧化氮可由NO和O2生成。800℃時,在2L密閉容器內,0.200molNO與0.100mol O2反應:2NO(g)+O2(g)?2NO2(g)ΔH的體系中,已知n(NO)隨時間的變化如圖所示: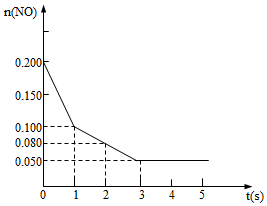
(2)已知:K(800°C)>K(1000°C),則該反應的ΔH0(填“>”或“<”),用NO2表示從0~2s內該反應的平均速率v(NO2)=。
(3)能說明該反應已達到平衡狀態的是。
a.容器內顏色保持不變
b.2v逆(NO)=c正(O2)
c.容器內壓強保持不變
d.容器內密度保持不變
(4)為使該反應的速率增大,提高NO的轉化率,且平衡向正反應方向移動應采取的措施有(任寫一條)。組卷:8引用:1難度:0.6 -
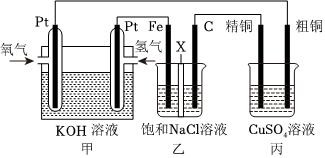 21.如圖所示,某化學興趣小組設計了一個燃料電池,并探究氯堿工業原理和粗銅精煉原理,其中乙裝置中X 為陽離子交換膜。根據要求回答相關問題:
21.如圖所示,某化學興趣小組設計了一個燃料電池,并探究氯堿工業原理和粗銅精煉原理,其中乙裝置中X 為陽離子交換膜。根據要求回答相關問題:
(1)通入氧氣的電極為(填“正極”或“負極”),通氫氣一極的電極反應式為;
(2)鐵電極為(填“陽極”或“陰極”),乙裝置中電解反應的化學方程式為。
(3)若在標準狀況下,有1.12L氧氣參加反應,丙裝置中陰極增重的質量為g;
(4)某粗銅中含有鐵、金、銀和鉑等雜質,通過電解精制后,為從電解液中制得硫酸銅晶體(CuSO4?5H2O),設計了如下工藝流程: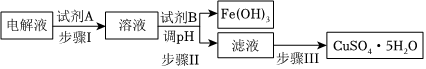
已知:幾種金屬陽離子開始沉淀和沉淀完全的pH:
①步驟Ⅰ中加入試劑A的目的是氫氧化物開始沉淀時的pH 氫氧化物沉淀完全時的pH Fe3+ 1.9 3.2 Fe2+ 7.0 9.0 Cu2+ 4.7 6.7 ,試劑A應選擇(填序號);
a.氯氣 b.過氧化氫 C.酸性高錳酸鉀溶液
選擇該試劑的原因;
②步驟II中試劑B為,調節pH的范圍是;
③步驟III的操作是加熱濃縮、、。組卷:36引用:4難度:0.5


