2013-2014學年河北省石家莊一中高二(上)開學化學試卷
發布:2024/12/18 6:0:2
一、選擇題(每題2分,共60分,每小題只有一個選項符合題意,請把符合題意的選項序號涂在答題卡上)
-
1.下列儀器:①集氣瓶 ②量筒 ③燒杯 ④表面皿 ⑤蒸發皿 ⑥容量瓶 ⑦燒瓶,能用酒精燈加熱的是( )
A.②③⑤ B.③⑥⑦ C.①③④ D.③⑤⑦ 組卷:262引用:13難度:0.9 -
2.2011年冬天,包括濟南在內的多個地區發生持續大霧天氣,“PM2.5”數據監測納入公眾視野.“PM2.5”是指大氣中直徑小于或等于2.5微米的細小顆粒物,也稱為可入肺顆粒物.下列有關說法中,錯誤的是( )
A.霧屬于膠體,能產生丁達爾現象 B.大霧的形成與汽車的尾氣排放沒有關系 C.持續大霧天氣給農業生產、交通運輸等帶來很大的影響 D.空氣中懸浮的細小顆粒物嚴重危害人體健康 組卷:35引用:7難度:0.9 -
3.下列有關試紙的敘述正確的是( )
A.用干燥潔凈的玻璃棒蘸取某溶液,滴在濕潤的pH試紙上,跟標準比色卡比較來測定該溶液的pH B.使濕潤的淀粉KI試紙變藍的氣體一定是氯氣 C.使濕潤的品紅試紙褪色的氣體必是SO2 D.使濕潤的紅色石蕊試紙變藍的氣體是氨氣 組卷:50引用:5難度:0.7 -
4.對1mol?L-1的BaCl2溶液的有關敘述中,正確的是( )
A.該溶液中Cl-濃度為2 mol?L-1 B.該溶液中Ba2+的物質的量是1 mol C.可使用250 mL容量瓶分兩次完成490 mL該濃度的BaCl2溶液的配制 D.將208 g BaCl2固體溶解在1 L水中,形成的溶液的濃度為1 mol?L-1 組卷:180引用:8難度:0.9 -
5.在①濃硝酸 ②水 ③濃硫酸 ④氫氟酸 ⑤氫氧化鉀溶液中,能與單質硅起化學反應的是( )
A.①② B.②④ C.④⑤ D.③④ 組卷:94引用:4難度:0.9 -
6.下列有關物質變化和分類的說法正確的是( )
A.電解熔融態的Al2O3、12C轉化為14C都屬于化學變化 B.膽礬、冰水混合物、四氧化三鐵都不是混合物 C.葡萄糖溶液和淀粉溶液的本質區別是能否發生丁達爾效應 D.SiO2、NO2、Al2O3都屬于酸性氧化物 組卷:77引用:13難度:0.9 -
7.下列邏輯關系圖中正確的是( )
A. 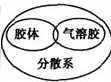
B. 
C. 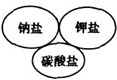
D. 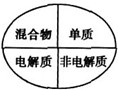 組卷:235引用:19難度:0.9
組卷:235引用:19難度:0.9 -
8.下列分子中所有原子都滿足最外層為8電子結構的是( )
A.SiCl4 B.H2O C.BF3 D.PCl5 組卷:94引用:87難度:0.9 -
9.下列除去雜質的操作方法不正確的是( )
A.除去SiO2中的少量NH4Cl:在空氣中充分灼燒 B.除去銅器表面的銅綠[Cu2(OH)2CO3]:用鹽酸浸泡,再用清水沖洗 C.除去CO2中混有的SO2:用NaOH溶液洗氣,再干燥 D.除去苯中溶解的Br2:加入足量NaOH溶液,充分振蕩后,靜置分液 組卷:20引用:2難度:0.7 -
10.下列關于SiO2和CO2的敘述中不正確的是( )
A.都是共價化合物 B.都是酸性氧化物,都能與強堿溶液反應 C.都能溶于水且與水反應生成相應的酸 D.SiO2可用于制光導纖維,干冰可用于人工降雨 組卷:65引用:11難度:0.9 -
11.下列分離方法不合理的是( )
A.用分餾的方法,可從石油中得到汽油 B.用點燃的方法除去CO2中的少量CO雜質 C.只含有泥沙的粗鹽,可通過溶解、過濾、結晶的方法提純 D.加入適量銅粉除去Cu(NO3)2溶液中的AgNO3雜質 組卷:15引用:2難度:0.9
二、試卷Ⅱ(共40分)
-
 33.二甲醚(CH3OCH3)是無色氣體,可作為一種新型能源.由合成氣(組成為H2、CO和少量的CO2)直接制備二甲醚,其中的主要過程包括以下四個反應:
33.二甲醚(CH3OCH3)是無色氣體,可作為一種新型能源.由合成氣(組成為H2、CO和少量的CO2)直接制備二甲醚,其中的主要過程包括以下四個反應:
甲醇合成反應:
(ⅰ)CO(g)+2H2(g)═CH3OH(g)△H1=-90.1kJ?mol-1
(ⅱ)CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2=-49.0kJ?mol-1
水煤氣變換反應:
(ⅲ)CO(g)+H2O(g)═CO2(g)+H2(g)△H3=-41.1kJ?mol-1
二甲醚合成反應:
(ⅳ)2CH3OH(g)═CH3OCH3(g)+H2O(g)△H4=-24.5kJ?mol-1
回答下列問題:
(1)Al2O3是合成氣直接制備二甲醚反應催化劑的主要成分之一,工業上從鋁土礦制備較高純度Al2O3的主要工藝流程是(以化學方程式表示).
(2)分析二甲醚合成反應(Ⅳ)對于CO轉化率的影響.
(3)由H2和CO直接制備二甲醚(另一產物的水蒸氣)的熱化學方程式為.根據化學反應原理,分析增加壓強對直接制備二甲醚反應的影響.
(4)有研究者在催化劑(含Cu-Zn-Al-O和Al2O3)、壓強為5.0MPa的條件下,由H2和CO直接制備二甲醚,結果如圖所示.其中CO轉化率隨溫度升高而降低的原因是.組卷:38引用:3難度:0.5 -
34.在1.0L密閉容器中放入0.10molA(g),在一定溫度進行如下反應:A(g)?B(g)+C(g )△H=+85.1kJ?mol-1
反應時間(t)與容器內氣體總壓強(p)的數據見下表:
回答下列問題:時間t/h 0 1 2 4 8 16 20 25 30 總壓強p/100kPa 4.91 5.58 6.32 7.31 8.54 9.50 9.52 9.53 9.53
(1)欲提高A的平衡轉化率,應采取的措施為。
(2)由總壓強p和起始壓強p0計算反應物A的轉化率α(A)的表達式為,
平衡時A的轉化率為,列式并計算反應的平衡常數K。
(3)①由總壓強p和起始壓強p0表示反應體系的總物質的量n總和反應后A的物質的量n(A),n總=mol,n(A)=mol。
②下表為反應物A濃度與反應時間的數據,計算:a=。
分析該反應中反應物的濃度c(A)變化與時間間隔(△t)的規律,得出的結論是反應時間t/h 0 4 8 16 c(A)/(mol?L-1) 0.10 a 0.026 0.0065 ,由此規律推出反應在12h時反應物的濃度c(A)為mol?L-1。組卷:736引用:21難度:0.5


