2020-2021學年安徽省合肥市新東方學校高二(下)月考化學試卷(1)0014
發布:2025/1/6 7:30:2
一、選擇題(共20題,每題只有一個選項符合每題3分,共60分)
-
1.下表物質與其所含化學鍵類型、所屬化合物類型完全正確的一組是( )
選項 A B C D 物質 CaF2 CaO2 H2SO4 H2O2 所含化學鍵類型 離子鍵、共價鍵 離子鍵、共價鍵 離子鍵、共價鍵 離子鍵、共價鍵 所屬化合物類型 離子化合物 離子化合物 離子化合物 離子化合物 A.A B.B C.C D.D 組卷:8引用:2難度:0.6 -
2.全氮類物質具有高密度、超高能量及爆炸產物無污染等優點,被稱為沒有核污染的“N2爆彈”。中國科學家胡炳成教授團隊近日成功合成全氮陰離子N5-,N5-是制備全氮類物質N10(其中含有N5+和N5-兩種離子)的重要中間體。下列說法中錯誤的是( )
A.全氮類物質N10屬于離子型物質 B.每個N5+中含有5個原子核 C.每個N5-中含有36個質子 D.N10結構中含非極性共價鍵和離子鍵 組卷:114引用:2難度:0.8 -
3.下列化學用語正確的是( )
A.金剛砂的化學式:SiC B.原子核內有7個中子的碳原子: C613C.用電子式表示氯化氫分子的形成過程: 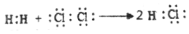
D.CO2分子的電子式為: 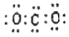 組卷:5引用:2難度:0.8
組卷:5引用:2難度:0.8 -
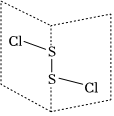 4.二氯化二硫(S2Cl2)是廣泛用于橡膠工業的硫化劑,其分子結構如圖所示。常溫下S2Cl2是種橙黃色的液體,遇水易水解,并產生能使品紅褪色的氣體,下列說法錯誤的是( )
4.二氯化二硫(S2Cl2)是廣泛用于橡膠工業的硫化劑,其分子結構如圖所示。常溫下S2Cl2是種橙黃色的液體,遇水易水解,并產生能使品紅褪色的氣體,下列說法錯誤的是( )A.非金屬性:Cl>S B.S2Cl2為含有極性鍵和非極性鍵的分子 C.S2Br2與S2Cl2結構相似,由于S-Cl鍵鍵能更大,S2Cl2熔沸點更高 D.S2Cl2與H2O反應的化學方程式可能為2S2Cl2+2H2O═SO2↑+3S↓+4HCl 組卷:23引用:2難度:0.7 -
5.下列說法中正確的有幾項( )
①在CS2、PCl5中各原子最外層內能達到8電子的穩定結構
②NaHSO4固體中陽離子和陰離子的個數比是1:1
③非金屬單質中一定含有共價鍵
④穩定性:H2O>H2S,沸點:H2O>H2S
⑤冰和干冰熔化時破壞作用力是相同的
⑥Na2O溶于水既有極性共價鍵的斷裂,又有極性共價鍵的形成
⑦碘晶體受熱轉變成碘蒸氣,吸收的熱量用于克服碘分子間范德華力
⑧金剛石、石墨、足球烯互為同位素A.3項 B.4項 C.5項 D.6項 組卷:13引用:2難度:0.7 -
6.將SO2分別通入無氧、有氧的濃度均為0.1mol?L-1的BaCl2溶液和Ba(NO3)2溶液中,除BaCl2溶液(無氧)外,都產生白色沉淀。實驗測得各溶液pH變化曲線如圖,下列說法正確的是( )
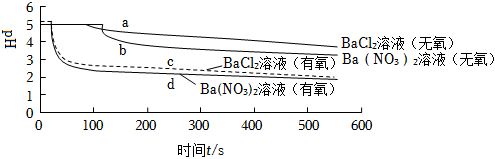
A.曲線a所示溶液pH降低的原因:SO2+H2O?H2SO3?2H++SO32- B.依據曲線b可推知0.2mol?L-1KNO3溶液(無氧)能氧化SO2 C.曲線c所示溶液中發生反應的離子方程式為:Ba2++SO2+O2═BaSO4↓ D.曲線d所表示的過程中NO3-是氧化SO2的主要微粒 組卷:34引用:4難度:0.5 -
7.實驗室中用濃硫酸與亞硫酸鈉制備SO2并探究其相關性質,所用實驗裝置如圖所示。(CCl4是一種密度比水大的有機溶劑,SO2不溶于CCl4)下列敘述不正確的是( )
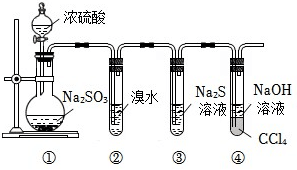
A.裝置①可用于實驗室制備O2 B.裝置②中溴水褪色說明SO2具有漂白性 C.裝置③中會出現渾濁現象,體現SO2的氧化性 D.裝置④中CCl4的作用是防倒吸 組卷:15引用:2難度:0.4
二、填空題(共2題,合計40分)
-
21.為了保護環境,充分利用資源,可將工業廢棄物轉變成重要的化工原料。回答下列問題:
(1)可用NaClO3氧化酸性FeCl2廢液得到FeCl3,FeCl3具有凈水作用,但腐蝕設備。
①寫出NaClO氧化酸性FeCl2的離子方程式:。
②鐵元素在周期表的位置是,鋼是用途最廣、用量最多的鐵合金,將少量的鋼樣品與足量熱的濃硫酸可發生多種化學反應,其中能生成兩種氣體的反應方程式為。
③與明礬凈水原理相似,FeCl3凈水的原理是:。
(2)可用廢鐵屑為原料,按下圖的工藝流程制備聚合硫酸鐵(PFS),PFS是一種新型絮凝劑,處理污水比FeCl3高效,且腐蝕性小。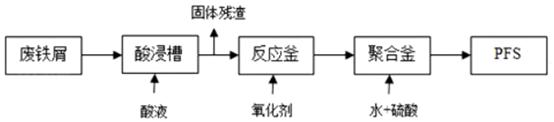
①酸浸時最合適的酸是。
②反應釜中加入的氧化劑,下列試劑中最合適的是(填標號)。
a.HNO3
b.KMnO4
c.Cl2
d.H2O2
③檢驗其中Fe2+是否完全被氧化,應選擇(填標號)。
a.K3[Fe(CN)6]溶液
b.Na2SO3溶液
c.KSCN溶液
相應的離子方程式為。
(3)大多數建筑廢料中含有硅酸鹽,傳統硅酸鹽材料有、、;二氧化硅能與一種酸反應,可根據此反應原理制雕花玻璃,這種酸是(填名稱)組卷:35引用:2難度:0.5 -
22.某中學學習小組模擬工業煙氣脫硫(SO2)。
(1)甲組采用如圖裝置脫硫(部分裝置略)。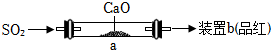
①CaO和SO2化合生成的產物是。
②b中品紅很快褪色,說明脫硫效果不好。下列措施能提高脫硫效果的是。
i.加快SO2氣體流速
ii.將堆集在一起的CaO平鋪在整個玻璃管
iii.加熱 a
(2)乙組選用AgNO3溶液脫除SO2,如圖所示: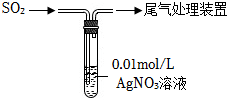
現象:通入SO2,立即生成大量白色沉淀A。對白色沉淀A的成分進行探究
提出假設:
假設1:發生了氧化還原反應,依據是AgNO3溶液中含有O2、NO3-等具有氧化性的微粒,沉淀A主要是Ag2SO4(微溶)。
假設2:發生了復分解反應,依據是SO2與水生成酸,然后與AgNO3溶液發生復分解反應。
實驗探究:
①取沉淀A,加入蒸餾水,靜置。取上層清液清加Ba(NO3)2溶液無明顯變化。
②取,加入蒸餾水,靜置。取上層清液滴加Ba(NO3)2溶液,產生沉淀。
實驗證明“假設1”不成立。
③為進一步確認“假設2”,向A中加入濃HNO3,立即產生紅棕色氣體。加入濃硝酸的目的是;經確認,反應后混合液中存在SO42-。
實驗證明“假設2”成立。
④產生沉淀A的化學方程式是,AgNO3溶液具有良好的脫硫能力,但并未大規模使用,可能的原因是。
(3)丙組用NaClO脫除SO2,用1L0.1mol/L的NaClO溶液最多可以吸收標準狀況下的SO2L。組卷:47引用:2難度:0.6


