2020-2021學年江西省新余市分宜中學課改班高一(下)第二次段考化學試卷
發布:2024/4/20 14:35:0
一、單選題(本大題共16小題,共48.0分)
-
1.分類是科學研究的重要方法,辨析以下說法:①氯水和氨水都是混合物;②金屬氧化物都屬于堿性氧化物;③膽礬既是純凈物又是化合物;④不銹鋼、硬鋁、硬幣都是合金;⑤氯氣、乙醇、葡萄糖都是非電解質;⑥豆漿和云霧都是膠體;上述說法正確的個數是( )
A.2個 B.3個 C.4個 D.5個 組卷:49引用:2難度:0.8 -
2.已知部分弱酸的電離平衡常數如表
下列說法正確的是( )弱酸 醋酸 次氯酸 碳酸 亞硫酸 電離平衡常數 (25℃) Ka=1.75×10-5 Ka=2.98×10-8 Ka1=4.3×10-7Ka2=5.61×10-11 Ka1=1.54×10-2Ka2=1.02×10-7 A.少量的SO2通入Ca(ClO)2溶液中的離子方程式為:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO B.少量CO2通入NaClO溶液中的離子方程式為:CO2+H2O+2ClO-=CO32-+2HClO C.Na2CO3溶液中緩慢通入少量SO2的離子方程式為:CO32-+SO2=SO32-+CO2 D.等物質的量濃度溶液pH由大到小的順序為:NaClO>CH3COONa>NaHSO3 組卷:98引用:1難度:0.7 -
3.已知氧化性:Br2>Fe3+,向含溶質amol FeBr2的溶液中通入bmol Cl2,充分反應。下列說法不正確的是( )
A.離子的還原性強弱:Fe2+>Br->Cl- B.當a=2b時,發生的離子反應:2Fe2++Cl2═2Fe3++2Cl- C.當a=b時,反應后的離子濃度:c(Fe2+):c(Br-):c(Cl-)=1:2:2 D.當3a=2b時,發生的離子反應:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- 組卷:144引用:3難度:0.8 -
4.化學與生活密切相關。下列化學事實敘述錯誤的是( )
A.鋁是地殼中儲量最豐富的金屬,其價格也比鐵的價格低 B.鐵不能與冷、熱水反應,但能與水蒸氣反應 C.碳酸鈉和碳酸氫鈉之所以可作食用堿或工業用堿,是因其溶液都顯堿性 D.鋁在高溫時可以燃燒,而氧化鋁卻可以作優良的耐火材料 組卷:43引用:2難度:0.8 -
5.某無色透明的混合氣體中可能含有Cl2、O2、SO2、NO、NO2中的兩種或多種氣體。現將此混合氣體通過品紅溶液后,品紅溶液褪色,向剩余氣體中通入空氣,很快變為紅棕色。下列對于原混合氣體成分的判斷中正確的是( )
A.肯定沒有SO2和NO B.肯定沒有Cl2、O2和NO2 C.可能有Cl2和O2 D.肯定只有NO2 組卷:19引用:2難度:0.7 -
6.短周期主族元素X、Y、Z、W的原子序數依次增大。Z是人體內含量最高的元素,Y原子的最外層電子數是其電子層數的2倍;X與Y不在同一周期,W與X同主族。下列說法不正確的是( )
A.原子半徑大小順序:r(W)>r(Y)>r(Z)>r(X) B.W分別與X、Z形成的化合物中化學鍵類型不一定完全相同 C.由X、Y、Z、W四種元素形成的化合物水溶液一定顯堿性 D.Z與W形成的原子個數比為1:1的化合物可以使石蕊溶液先變藍后褪色 組卷:15引用:2難度:0.7 -
7.用CH4催化還原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=CO2(g)+4NO(g)+2H2O(g)△H=-574kJ/mol
②CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(g)△H=-1160kJ/mol
下列說法不正確的是( )A.若用標準狀況下4.48L CH4還原NO2生成N2和水蒸氣,放出的熱量為173.4 kJ B.由反應①可推知:CH4(g)+4NO2(g)=CO2(g)+4NO(g)+2H2O(l)△H<-574 kJ/mol C.反應①②中,相同物質的量的甲烷發生反應,轉移的電子數相同 D.反應②中,當4.48L甲烷反應完全時轉移的電子的物質的量為1.60mol 組卷:33引用:5難度:0.7
三、實驗題(本大題共1小題,共10.0分)
-
20.如圖為實驗室制取純凈、干燥的氯氣,并驗證氯氣性質的裝置。其中E瓶放有干燥紅色布條;F中為紅色的銅網,其右端出氣管口放有脫脂棉。

(1)A裝置的名稱為。
(2)B中發生反應的化學方程式為。
(3)裝置C中盛裝的溶液是,D中試劑的作用是。
(4)E中的紅色布條是否褪色?。(填“是”或“否”)寫出F中反應的反應現象為。
(5)取一定量的濃鹽酸使其與二氧化錳發生反應,產生的氯氣在標準狀況下的體積為6.72L。則反應中被氧化的HCl的物質的量為。
(6)H中的試劑為,用來吸收多余氯氣。工業上常用廉價的石灰乳吸收工業氯氣尾氣制得漂粉精,該反應的化學方程式為:。組卷:166引用:3難度:0.6
四、計算題(本大題共1小題,共8.0分)
-
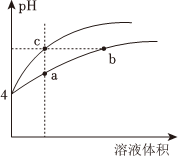 21.(1)某溫度下,pH均為4的鹽酸和醋酸溶液分別加水稀釋,其pH隨溶液體積變化的曲線圖中abc三點對應的溶液中水的電離程度由大到小的順序是 ;該醋酸溶液稀釋過程中,下列各量一定變小的是。
21.(1)某溫度下,pH均為4的鹽酸和醋酸溶液分別加水稀釋,其pH隨溶液體積變化的曲線圖中abc三點對應的溶液中水的電離程度由大到小的順序是 ;該醋酸溶液稀釋過程中,下列各量一定變小的是。
a.c(H+)
b.c(OH-)
c.c(CH3COOH)c(OH-)c(CH3COO-)
d.c(CH3COOH)c(H+)
(2)在t℃時,某NaOH稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,則:
①該溫度下水的離子積常數Kw=(mol/L)-2;
②在該溫度下,將100mL 0.1mol/L的稀硫酸與100mL 0.4mol/L的NaOH溶液混合后,溶液中c(OH-)=mol/L,溶液的pH=。組卷:8引用:1難度:0.7


