2022-2023學年湖南省長沙麓山國際實驗學校高一(上)期末化學試卷
發布:2024/11/11 4:30:2
一.單項選擇題。(共10個小題,每小題3分,共30分)
-
1.化學與日常生活息息相關。下列說法錯誤的是( )
A.使用含氟牙膏能預防齲齒 B.小蘇打的主要成分是Na2CO3 C.可用食醋除去水垢中的碳酸鈣 D.使用食品添加劑不應降低食品本身營養價值 組卷:286引用:6難度:0.8 -
2.設NA為阿伏加德羅常數的值,下列說法正確的是( )
A.2.0gH218O與D2O的混合物中所含中子數為NA B.1molCu和足量熱濃硫酸反應可生成NA個SO3分子 C.標準狀況下,5.6LCO2與足量Na2O2反應轉移的電子數為0.5NA D.50mL12mol/L鹽酸與足量MnO2共熱,轉移的電子數為0.3NA 組卷:23引用:1難度:0.6 -
3.把VL含有MgSO4和K2SO4的混合溶液分成兩等份,一份加入含amol NaOH的溶液,恰好使鎂離子完全沉淀為氫氧化鎂;另一份加入含bmol BaCl2的溶液,恰好使硫酸根離子完全沉淀為硫酸鋇。則原混合溶液中鉀離子的濃度為( )
A. mol?L-1b-aVB. mol?L-12b-aVC. mol?L-12(b-a)VD. mol?L-12(2b-a)V組卷:271引用:6難度:0.7 -
4.用如圖裝置進行實驗,將液體A逐滴加入到固體B中,下列敘述正確的是( )
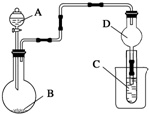
A.若A為濃鹽酸,B為Na2CO3,C中盛有Na2SiO3溶液,則C中溶液出現白色沉淀,證明酸性:H2CO3>H2SiO3 B.若A為濃鹽酸,B為KMnO4,C中盛石蕊試液,則C中溶液最終呈紅色 C.若A為較濃硫酸,B為Na2SO3固體,C中盛有Na2S溶液,則C中溶液變渾濁 D.裝置D起干燥氣體作用 組卷:64引用:13難度:0.6 -
5.下列離子方程式書寫錯誤的是( )
A.向明礬溶液中滴加Ba(OH)2溶液,使沉淀的物質的量最大時:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ B.向次氯酸鈉溶液中通入少量二氧化碳的離子方程式:ClO-+CO2+H2O═HCO3-+HClO C.等物質的量MgCl2、Ba(OH)2和HCl溶液混合:Mg2++3OH-+H+═Mg(OH)2↓+H2O D.Ca(HCO3)2溶液與澄清石灰水按溶質物質的量之比2:3混合:Ca2++HCO3-+OH-═CaCO3↓+H2O 組卷:63引用:3難度:0.6 -
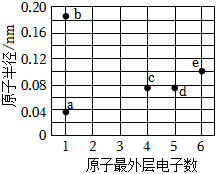 6.a、b、c、d、e均為短周期主族元素,其原子半徑和最外層電子數的關系如圖所示。下列說法正確的是( )
6.a、b、c、d、e均為短周期主族元素,其原子半徑和最外層電子數的關系如圖所示。下列說法正確的是( )A.單質的熔沸點:c<d B.元素的非金屬性:c<d<e C.a與b、e均形成共價化合物 D.d、e的最高價含氧酸均為強酸 組卷:67引用:7難度:0.5
三.非選擇題:(本題共4小題,共54分。)
-
17.MnO2在常溫下化學性質非常穩定,但在加熱條件下可以體現氧化性或還原性。
Ⅰ.某實驗小組計劃使用MnO2與濃鹽酸制備并收集少量Cl2,實驗裝置如圖所示: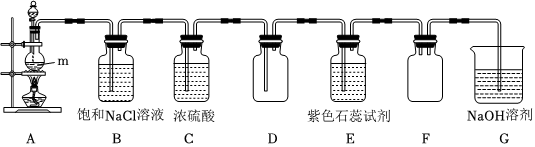
(1)儀器m的名稱為,裝置A中發生反應的化學方程式為。
(2)裝置B的作用為,裝置F的作用為。
(3)在實驗進行過程中,小組成員觀察到裝置E中的紫色石蕊試液先變紅后褪色,這一現象發生的原因為。
Ⅱ.實驗室中可以利用MnO2堿熔法來制備KMnO4晶體,其步驟如圖所示: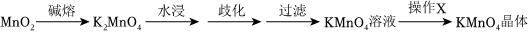
(4)高溫條件下坩堝中發生反應的化學方程式為①堿熔:在鐵制坩堝中將一定量的KClO3與KOH的混合物用酒精噴燈加熱至熔化后,向其中逐步加入MnO2粉末并用鐵棒攪拌,待加熱至5分鐘時關閉酒精噴燈,冷卻到室溫后可見坩堝中存在墨綠色的塊狀固體,其中主要成分為K2MnO4與KCl。
②水浸:將坩堝中的塊狀固體轉移至燒杯中,加足量水溶解。
③歧化:向所得的K2MnO4溶液中通入適量的CO2,促使K2MnO4歧化為KMnO4與MnO2。
④過濾:除去溶液中的不溶性物質。
⑤操作X:加熱濃縮、冷卻結晶、過濾、干燥。;為了加快水浸時固體的溶解速率,可以采取的措施有(寫兩條)。
(5)操作X中空缺的內容為;使用恒溫烘箱對所得的KMnO4晶體進行干燥時,儀器內部溫度一般不宜超過120℃,這是由于。組卷:18引用:2難度:0.5 -
18.某磁鐵礦石A的主要成分是磁性氧化鐵(Fe3O4),還含少量的Al2O3、Cu2O。某工廠利用此礦石進行有關物質的回收利用,工藝流程如圖:(已知Cu2O不溶于水和堿,但溶于酸:Cu2O+2H+=Cu+Cu2++H2O)。根據流程(圖1)回答下列問題:
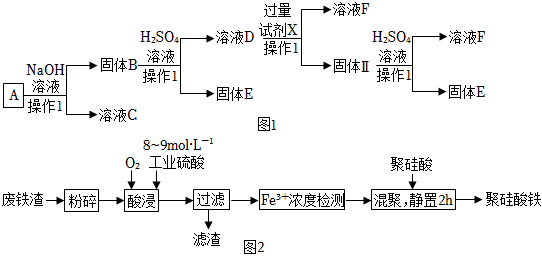
(1)溶液C的主要成分是。
(2)溶液D中的金屬陽離子與過量試劑X反應的離子方程式是。
(3)在溶液F中滴加NaOH溶液的現象是;發生的化學反應方程式為。
(4)聚硅酸鐵是目前無機高分子絮凝劑研究的熱點,一種用鋼管廠的廢鐵渣(主要成分Fe3O4,含少量碳及二氧化硅)為原料制備的流程如圖2:
①加熱條件下酸浸時,Fe3O4與硫酸反應。酸浸時,通入O2的目的是。
②“Fe3+濃度檢測”是先將100mL含Fe3+溶液用適量的SnSO4還原為Fe2+;再用酸性K2Cr2O7標準溶液測定Fe2+的量(Cr2O72-被還原為Cr3+),此時發生反應的離子方程式為:。若用掉0.2mol?L-1K2Cr2O7溶液50mL,則Fe3+的物質的量濃度為。組卷:41引用:3難度:0.6


