2022-2023學年湖南省株洲市攸縣一中高二(上)期中化學試卷
發布:2024/9/6 2:0:8
一、選擇題(本題包括10小題,每小題3分,共30分。在每小題給出的四個選項中,只有一項是符合題目要求的)
-
1.小郡同學在做“典籍里的化學”項目研究時,收集到四個素材,從氧化還原的角度分析,其中一個與其他三個明顯不同。這個素材是( )
A.煮豆燃豆萁——曹植,《七步詩》 B.爆竹聲聲一歲除——王安石,《元日》 C.要留清白在人間——于謙,《石灰吟》 D.曾青得鐵則化為銅——淮南王劉安,《淮南萬畢術》 組卷:16引用:7難度:0.7 -
2.已知298.15K時,可逆反應:Pb2+(aq)+Sn(s)?Pb(s)+Sn2+(aq)的平衡常數K=2.2,若溶液中Pb2+和Sn2+的濃度均為0.010mol?L-1,則反應進行的方向是( )
A.向右進行 B.向左進行 C.處于平衡狀態 D.無法判斷 組卷:133引用:7難度:0.7 -
 3.在二氧化碳加氫制甲醇的反應體系中,主要發生反應的熱化學方程式為
3.在二氧化碳加氫制甲醇的反應體系中,主要發生反應的熱化學方程式為
反應Ⅰ:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-49.5kJ?mol-1
反應Ⅱ:CO(g)+2H2(g)═CH3OH(g)△H2
反應Ⅲ:CO2(g)+H2(g)═CO(g)+H2O(g)△H3=40.9kJ?mol-1
在體積為1L的恒容密閉容器中通入1mol CO2和3mol H2,發生上述反應,CO2的平衡轉化率隨溫度和壓強的變化如圖所示。下列說法正確的是( )A.△H2=90.4kJ?mol-1 B.在某溫度下,平衡時容器中CH3OH(g)為0.3mol,CO(g)為0.3mol,則反應Ⅲ的平衡常數為0.25 C.壓強p1、p2、p3由小到大的順序為p1<p2<p3 D.高溫、高壓一定有利于提高CO2的平衡轉化率 組卷:26引用:2難度:0.6 -
4.活潑自由基與氧氣的反應一直是關注的熱點。HNO自由基與O2反應過程的能量變化如圖所示。下列說法正確的是( )
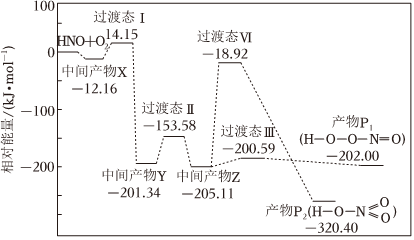
A.該反應為吸熱反應 B.產物的穩定性:P1>P2 C.該歷程中最大正反應的活化能E正=186.19kJ?mol-1 D.相同條件下,由中間產物z轉化為產物的速率:v(P1)<v(P2) 組卷:254引用:24難度:0.8 -
5.常溫下,現有pH=3的鹽酸和醋酸溶液,下列說法正確的是( )
A.兩種酸溶液中c(CH3COO-)=c(Cl-) B.分別加水稀釋10倍后溶液的pH均變為4 C.中和等物質的量的氫氧化鈉,消耗酸的體積:鹽酸<醋酸 D.等體積的兩種酸溶液分別與足量的鋅粒反應,產生氣體的體積相等 組卷:16引用:5難度:0.6 -
6.相同溫度下,根據三種酸的電離平衡常數,下列判斷正確的是( )
酸 HX HY HZ 電離平衡常數Ka 9×10-7 9×10-6 1×10-2 A.三種酸的強弱關系:HX>HY>HZ B.反應HZ+Y-═HY+Z-不能發生 C.由電離平衡常數可以判斷:HZ屬于強酸,HX和HY屬于弱酸 D.相同溫度下,1mol?L-1HX溶液的電離平衡常數等于0.1mol?L-1HX溶液的電離平衡常數 組卷:94引用:2難度:0.6
三、非選擇題(本題包括2小題.共27分.)
-
17.鹽類的水解在生產生活中應用廣泛
(1)FeCl3具有凈水作用,但腐蝕設備,而聚合氯化鐵是一種新型的絮凝劑,處理污水比FeCl3高效,且腐蝕性小。請回答下列問題:FeCl3在溶液中分三步水解:
Fe3++H2O?Fe(OH)2++H+K1
Fe(OH)2++H2O?Fe(OH)2++H+K2
Fe(OH)2++H2O?Fe(OH)3+H+K3
以上水解反應的平衡常數K1、K2、K3由大到小的順序是。通過控制條件,以上水解產物聚合,生成聚合氯化鐵,離子方程式為xFe3++yH2O?Fe′x(OH)y3x-y+yH+,欲使平衡正向移動可采用的方法是(填標號)。
a.降溫
b.加水稀釋
c.加入NH4Cl
d.加入NaHCO3
室溫下,使氯化鐵溶液轉化為高濃度聚合氯化鐵的關鍵條件是。
(2)現有常溫下的0.1mol/L純堿溶液。
①你認為該溶液呈堿性的原因是(用離子方程式表示)。為證明你的上述觀點,請設計實驗,簡述實驗操作,現象和結論:。
②同學甲認為該溶液中Na2CO3的水解是微弱的,發生水解的CO3不超過其總量的10%,請你設計實驗證明該同學的觀點是否正確(忽略CO3的第二步水解):。組卷:50引用:2難度:0.7 -
18.甲醇是重要的化工原料,利用合成氣(主要成分為CO、CO2和H2)在催化劑作用下合成甲醇,相關反應的熱化學方程式為:
ⅰ.CO(g)+2H2(g)?CH3OH(g)ΔH=akJ/mol;
ⅱ.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)ΔH=bkJ/mol;
ⅲ.CO2(g)+H2(g)?CO(g)+H2O(g)ΔH=-ckJ/mol。
回答下列問題:
(1)a=(用b、c表示),已知反應ⅱ在一定條件下可自發進行,則b(填“>”“<”或“=”)0。
(2)在一定溫度下,向體積為1L的恒容密閉容器中通入等物質的量的CO2與H2,在催化劑的作用下僅發生反應ⅲ。
①下列敘述能表示該反應達到平衡狀態的是(填標號)。
a.容器中混合氣體的壓強不再改變
b.容器中CO、CO2的物質的量相等
c.容器中氣體的密度不再改變
d.相同時間內,斷裂H-O的數目是斷裂H-H的2倍
②該反應達到平衡時,其他條件不變,通入CO2時,則v(正)(填“>”“<”或“=”)v(逆),平衡常數(填“變大”“變小”或“不變”)。
(3)一定溫度下,向體積為2L的恒容密閉容器中通入CO、H2、CH3OH,發生反應ⅰ,其中X、Y的物質的量與時間的關系如圖所示,反應進行1min時三種物質的體積分數均相等。
①Y為(填化學式)。
②0~1min時v(CO)為mol/(L?min)。
③該溫度下,該反應的平衡常數Kc=。組卷:23引用:4難度:0.5


