2021-2022學年江蘇省鎮江市五校高二(下)期末化學試卷
發布:2024/12/15 5:30:3
一、單項選擇題:共14題,每題3分,共42分。每題只有一個選項最符合題意。
-
1.工業上曾經通過反應3Fe+4NaOH
Fe3O4+2H2↑+4Na↑生產金屬鈉。下列說法正確的是( )1100℃A.該反應屬于置換反應 B.用磁鐵可以將Fe和Fe3O4分離 C.反應中NaOH是氧化劑 D.將生成的氣體在空氣中冷卻可獲得鈉 組卷:52引用:2難度:0.7 -
2.硼酸和乙醇可以發生酯化反應:B(OH)3+3C2H5OH
(C2H5O)3B+3H2O。生成的硼酸三乙酯點燃時產生綠色火焰,可通過該現象鑒定硼酸,下列表示正確的是( )濃H2SO4△A.中子數為8的O原子: O88B.乙醇分子的比例模型: 
C.基態C原子核外價電子的軌道表達式: 
D.硼酸在水中的電離方程式:B(OH)3+H2O=B(OH) +H+-4組卷:31引用:2難度:0.7 -
3.下列有關物質的性質與用途具有對應關系的是( )
A.氨氣具有還原性,可用作煙氣中NOx脫除 B.Al2O3熔點高,可用作電解冶煉鋁的原料 C.濃硫酸具有強氧化性,可用作酯化反應的催化劑 D.次氯酸具有弱酸性,可用作有色物質的漂白劑 組卷:9引用:1難度:0.8 -
4.閱讀下列資料,回答4~6題:
藍天保衛戰——持續三年的大氣治理之戰,其中低成本、高效率處理SO2、NO2等大氣污染物一直是化學研究的重點課題,研究它們的性質、制備在工業生產和環境保護中有著重要意義。一種處理SO2、NO2的研究成果,其反應原理為SO2(g)+NO2(g)?SO3(g)+NO(g) ΔH=-41.8kJ?mol-1。
下列有關SO2、SO3的說法正確的是( )A.SO2水溶液能導電,SO2是電解質 B.SO2的鍵角小于SO3的鍵角 C.SO2、SO3都是極性分子 D.SO2的水溶液放置在空氣中,pH會增大 組卷:7引用:0難度:0.60 -
5.閱讀下列資料,回答4~6題:
藍天保衛戰——持續三年的大氣治理之戰,其中低成本、高效率處理SO2、NO2等大氣污染物一直是化學研究的重點課題,研究它們的性質、制備在工業生產和環境保護中有著重要意義。一種處理SO2、NO2的研究成果,其反應原理為SO2(g)+NO2(g)?SO3(g)+NO(g) ΔH=-41.8kJ?mol-1。
在指定條件下,下列選項所示的物質間的轉化能夠實現的是( )A.SO2 NH4HSO3(aq)過量NH3?H2OB.SO3 Br2HBrC.FeS2 SO2O2點燃D.濃H2SO4 SO2S△組卷:4引用:0難度:0.70
二、非選擇題:共4題,共58分。
-
17.Li2CO3可用于制備鋰電池的正極材料LiCoO2,以某鋰云母礦石(主要成分為Li2O,還有Al2O3、Fe2O3、MnO、MgF2等雜質)制備Li2CO3。
已知:
①Ksp[Fe(OH)3]=4.0×10 -38、Ksp[Mn(OH)2]=2×10-13、Ksp[Mg(OH)2]=1.2×10-11、Ksp[Al(OH)3]=1.0×10 -33
②Co3O4、CoO均難溶于水。Co3O4難溶于酸,CoO能溶于酸中。
③當溶液中的離子濃度小于10-5mol/L時,已完全沉淀。
④部分物質的溶解度曲線如圖2所示。
利用鋰云母礦石制備Li2CO3步驟如下:
(1)酸浸。
向鋰云母礦石中加入30%硫酸,加熱至90℃,裝置如圖1所示。燒杯中試劑的作用是。
(2)調pH。
向酸浸后的溶液中加入NaOH溶液,調節pH約為6,過濾。再向濾液中繼續滴加氫氧化鈉溶液調pH>13,過濾,此時的濾渣主要成分為。分兩次調節pH的主要原因是。
(3)沉鋰。
將已經除雜的溶液蒸發濃縮,向濃縮后的濾液中加入稍過量飽和Na2CO3溶液,加熱煮沸,趁熱過濾,將濾渣洗滌烘干,得Li2CO3固體。濃縮液中離子濃度過大將在產品中引入雜質(填化學式)。
(4)Li2CO3和Co3O4混合后,在空氣中高溫加熱可以制備鋰電池的正極材料LiCoO2,寫出反應方程式:。
(5)Co3O4可由CoCO3熱分解制備。CoCO3在有氧和無氧環境下的所得Co3O4和CoO的百分含量與溫度關系如7圖3所示。請補充完整由CoCO3制備較純凈的Co3O4實驗方案,取一定質量的CoCO3于熱解裝置中,,干燥。(須使用的試劑和儀器有:1mol/LH2SO4,蒸餾水,BaCl2溶液) 組卷:98引用:6難度:0.3
組卷:98引用:6難度:0.3 -
18.水體中的六價鉻[Cr(Ⅵ)]對生態環境和人體健康威脅很大。工業廢水中[Cr(Ⅵ)]常用還原沉淀法、微生物法等進行處理。
(1)“還原沉淀法”常用Na2SO3、FeSO4等處理Cr(Ⅵ)得到Cr(Ⅲ)。
已知溶液中含Cr(Ⅵ)的微粒(H2CrO4、Cr2和O2-7)的物質的量分數隨pH的關系如圖1所示。CrO2-4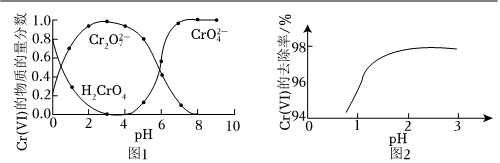
①某含Cr(Ⅵ)廢水的pH約為8,寫出用Na2SO3處理該廢水的主要離子方程式:。[已知pH=3時,Cr(Ⅲ)以Cr3+形式存在,pH=7.5時,Cr(Ⅲ)開始沉淀]。
②其他條件相同,用Na2SO3處理不同pH含Cr(Ⅵ) 的廢水,反應相同時間,Cr(Ⅵ)的去除率與pH的關系如圖2所示。已知酸性條件下Cr(Ⅵ)對Na2SO3具有很強的氧化能力,pH<2時,Cr(Ⅵ)的去除率隨pH降低而降低的原因是。
③研究發現,用FeSO4處理pH=3的含Cr(Ⅵ)廢水,Cr(Ⅵ)的去除率大于其被FeSO4還原的理論值。Cr(Ⅵ)的去除率大于理論值的原因是。
(2)“微生物法”處理含Cr(Ⅵ)廢水具有效率高、選擇性強、吸附容量大等優點。一種微生物法是用硫酸鹽還原菌(SRB)處理含Cr(Ⅵ)廢水。
①硫酸鹽還原菌能將水中的轉化為S2-,S2-與SO2-4可反應生成Cr2S3和S兩種沉淀。寫出S2-與CrO2-4反應的離子方程式:CrO2-4。
②用硫酸鹽還原菌(SRB)處理含鉻廢水時,溫度常控制在30℃左右,溫度過高,Cr(Ⅵ)的去除率低的原因是。
③硫酸鹽還原菌(SRB)常存在于水體中,會腐蝕許多金屬及合金。一種Fe合金在硫酸鹽還原菌存在條件下腐蝕的機理如圖3所示。已知溶液中的S2-會完全轉化為FeS,則Fe腐蝕后生成Fe(OH)2和FeS的物質的量之比為。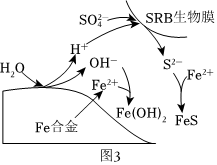 組卷:66引用:3難度:0.6
組卷:66引用:3難度:0.6


