2023年北京市育英學校高考化學三模試卷
發布:2024/6/15 8:0:9
一、(本部分共14題,每題3分,共42分)
-
 1.中國首次在月球上發現新礦物并命名為“嫦娥石”,其晶體組成為Ca8YFe(PO4)7。39Y是一種稀土元素,常以Y3+形式存在。下列說法不正確的是( )
1.中國首次在月球上發現新礦物并命名為“嫦娥石”,其晶體組成為Ca8YFe(PO4)7。39Y是一種稀土元素,常以Y3+形式存在。下列說法不正確的是( )A.Y屬于金屬元素 B.Ca屬于s區元素 C.嫦娥石中Fe的化合價為+3 D.可利用X射線衍射法獲取其晶體結構 組卷:64引用:7難度:0.7 -
2.下列化學用語或圖示表達正確的是( )
A.HClO的電子式: 
B.中子數為1的氫原子: H21C.NaCl的晶胞: 
D.反-2-丁烯的結構簡式:  組卷:57引用:5難度:0.7
組卷:57引用:5難度:0.7 -
3.導航衛星的原子鐘被稱為衛星的“心臟”,目前我國使用的是銣原子鐘。已知,自然界存在兩種銣原子85Rb和87Rb,87Rb具有放射性。下列說法不正確的是( )
A.Rb位于元素周期表中第六周期、第ⅠA族 B.可用質譜法區分85Rb和87Rb C.85Rb和87Rb是兩種不同的核素 D.87Rb的化合物也具有放射性 組卷:66引用:3難度:0.7 -
4.下列離子方程式書寫正確的是( )
A.Cl2通入水中制氯水:Cl2+H2O=2H++Cl-+ClO- B.可用Na2SO3溶液吸收少量Cl2:3 +Cl2+H2O=2SO2-3+2Cl-+HSO-3SO2-4C.過量鐵粉與稀硝酸反應:Fe+ +4H+=Fe3++NO↑+2H2ONO-3D.NaHCO3溶液與少量Ba(OH)2溶液混合: +Ba2++OH-=BaCO3↓+H2OHCO-3組卷:142引用:4難度:0.5 -
5.為除去某NaCl樣品中少量的
,取適量該NaCl樣品溶解后,依次進行如圖操作:SO2-4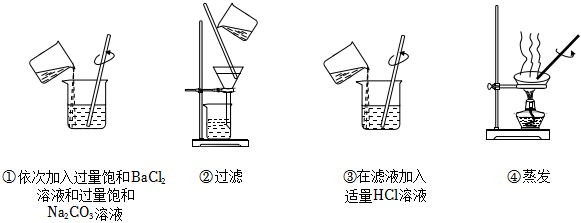
已知:Ksp(BaSO4)=1.1×10-10 Ksp(BaCO3)=5.1×10-9
取少量提純后的NaCl固體,加水溶解,向溶液中滴加BaCl2溶液,仍能看到白色渾濁。為提高的去除率,下列改進操作有效的是( )SO2-4A.在步驟①加入兩種溶液之間增加一次過濾操作 B.在步驟②后增加沉淀的洗滌操作 C.在步驟③中加入略過量的HCl溶液 D.步驟④改為小火加熱濃縮,之后降溫結晶 組卷:76引用:3難度:0.7 -
6.將濃氨水分別滴加到下列試劑中,產生的實驗現象、體現出的NH3?H2O性質以及對應的方程式不正確的是( )
實驗 試劑 現象 性質 方程式 A 滴有酚酞的蒸餾水 溶液變紅 堿性 NH3?H2O═ +OH-NH+4B 氯氣 產生白煙 還原性 3Cl+8NH3?H2O═N2+6NH4Cl+8H2O C 燒堿固體 產生刺激性氣味的氣體 不穩定性 NH3?H2O NH3↑+H2O△D CuSO4溶液 溶液最終變為深藍色 可形成配合物 Cu2++4NH3?H2O═[Cu(NH3)4]2++4H2O A.A B.B C.C D.D 組卷:186引用:4難度:0.7
二、(本部分共5題,共58分)
-
18.錳酸鋰離子蓄電池是第二代鋰離子動力電池,性能優良。工業上用某軟錳礦(主要成分為MnO2,還含有少量鐵、鋁及硅等氧化物)為原料制備錳酸鋰(LiMn2O4)。流程如圖:
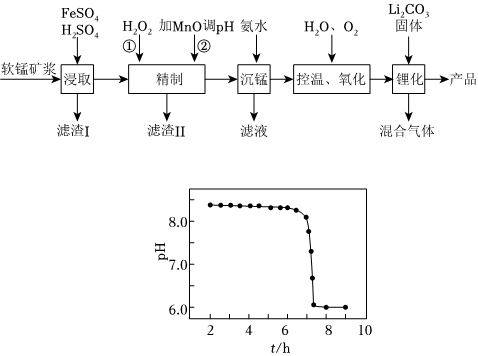
(1)“浸取”得到的浸取液中陽離子主要是Mn2+,生成Mn2+的離子方程式為。
(2)濾渣Ⅱ的主要成分是;“精制”中加入H2O2的量比理論值大得多,其主要原因是。
(3)“沉錳”得到的是Mn(OH)2和Mn2(OH)2SO4濾餅,二者均可被氧化為MnO2,若控溫氧化時溶液的pH隨時間的變化如圖,其中pH下降的原因是(用化學方程式表示)。
(4)工業上也可以將“精制”后的濾液加入K2S2O8來合成MnO2。K2S2O8中S的化合價為+6價,加入K2S2O8溶液合成MnO2發生反應的離子方程式為。
(5)“鋰化”是將MnO2和Li2CO3按4:1的物質的量比配料,球磨3~5h,然后升溫至600~750℃,保溫24h,自然冷卻至室溫得產品。所得混合氣體的成分是。
(6)為測定成品錳酸鋰的純度,實驗室可通過連續滴定法測定錳酸鋰中錳元素的平均價態。
進行如下實驗:
步驟1:取少量成品錳酸鋰(假設為LiMnxOy)分成兩等份,分別置于兩只錐形瓶中;
步驟2:向一只錐形瓶中加入稀硝酸和雙氧水,完全反應后,LiMnxOy中Mn元素轉化為Mn2+,除去過量的雙氧水。調節pH,滴加指示劑,用濃度為0.300mol?L-1的EDTA標準溶液滴定,終點時消耗EDTA標準溶液20.00mL(已知:Mn2+與EDTA反應的化學計量數之比為1:1);
步驟3:向另一錐形瓶中加入1.340gNa2C2O4和足量硫酸,充分反應后,用0.100mol?L-1KMnO4標準溶液滴定,到達滴定終點時消耗KMnO4標準溶液20.80mL。已知:LiMnxOyMn2+;H2SO4+Na2C2O4
則此成品錳酸鋰LiMnxOy中Mn元素的平均化合價為。組卷:94引用:5難度:0.4 -
19.某小組同學探究銅和濃硝酸的反應,進行如下實驗:
實驗1:分別取3mL濃硝酸與不同質量的銅粉充分反應,銅粉完全溶解,溶液顏色如表:
(1)寫出銅和濃硝酸反應的離子反應方程式:編號 ① ② ③ ④ ⑤ 銅粉質量/g 0.1 0.2 0.3 0.4 0.5 溶液顏色 綠色 草綠色 藍綠色偏綠 藍綠色偏藍 藍色 。
(2)小組同學認為溶液呈綠色的可能原因是:
猜想1:硝酸銅濃度較高,溶液呈綠色;
猜想2:NO2溶解在硝酸銅溶液中,溶液呈綠色。
依據實驗1中的現象,判斷猜想1是否合理,并說明理由:。
(3)取⑤中溶液,(填操作和現象),證實猜想2成立。
(4)小組同學進行如下實驗也證實了猜想2成立。
實驗2:向①中溶液以相同流速分別通入N2和空氣,觀察現象。
結合上述實驗現象,下列推測合理的是通入氣體 氮氣 空氣 現象 液面上方出現明顯的紅棕色氣體,25min后溶液變為藍色 液面上方出現明顯的紅棕色氣體,5min后溶液變為藍色 (填字母序號)。
a.①中溶液通入N2時,N2被緩慢氧化為NO2
b.①中溶液里某還原性微粒與綠色有關,通入空氣時較快被氧化
c.空氣中的CO2溶于水顯酸性,促進了溶液變藍色
d.加熱溶液①后,可能觀察到溶液變藍的現象
(5)小組同學繼續探究實驗2中現象的差異,并查閱文獻知:
ⅰ.“可溶性銅鹽中溶解亞硝酸 (HNO2)”可能是實驗①中溶液顯綠色的主要原因
ⅱ.NO2在溶液中存在:
反應1:2NO2+H2O?HNO3+HNO2(慢)
反應2:2HNO2?NO2+NO+H2O(快)
解釋實驗2中“通入氮氣變藍慢,通入空氣變藍快”的原因。
(6)小組同學為確認亞硝酸參與了形成綠色溶液的過程,繼續進行實驗。
實驗3:取3份等體積的①中綠色溶液,分別加入不同物質,觀察現象。
實驗中加入的固體物質是加入物質 固體 3滴30%H2O2溶液 3滴水 現象 溶液綠色變深 溶液迅速變為藍色 溶液顏色幾乎不變 (填化學式),加入H2O2后溶液迅速變藍可能的原因是(用化學方程式表示):H2O2+2NO2═2HNO3,,。組卷:86引用:7難度:0.5


