2022-2023學年安徽省合肥一中高二(下)期末化學試卷
發布:2024/8/2 8:0:9
一、選擇題共42分
-
1.化學與生活密切相關,下列說法不正確的是( )
A.醫用藥膏中的“凡士林”和蠟燭中的石蠟,其主要成分是含碳原子數較多的烷烴 B.聚氯乙烯耐化學腐蝕、機械強度高,但熱穩定性差,受熱易分解出HCl C.工業上用物理方法將纖維素、蛋白質等加工成黏膠纖維、大豆蛋白纖維等再生纖維 D.通過煤的干餾或者石油的減壓蒸餾都能獲得瀝青 組卷:21引用:1難度:0.8 -
2.中國“天宮”空間站使用了很多高新技術材料。下列關于材料的說法不正確的是( )
A.核心艙的離子推進器使用氙氣作為推進劑,氙位于元素周期表p區 B.被譽為“百變金剛”的太空機械臂主要成分為鋁合金,其強度大于純鋁 C.“問天”實驗艙使用砷化鎵(GaAs)太陽能電池,砷和鎵位于元素周期表第四周期 D.太陽能電池翼基板采用碳纖維框架和玻璃纖維網,兩者均屬于有機高分子材料 組卷:15引用:1難度:0.7 -
3.現有四種元素基態原子的電子排布式如圖。則下列有關比較中正確的是( )
①1s22s22p63s23p4
②1s22s22p63s23p3
③1s22s22p3
④1s22s22p5A.第一電離能:④>③>①>② B.原子半徑:②>①>③>④ C.電負性:④>①>②>③ D.最高正化合價:④>③=②>① 組卷:41引用:2難度:0.7 -
4.下列對有關事實的解釋正確的是( )
事實 解釋 A 某些金屬鹽灼燒呈現不同焰色 電子從低能軌道躍遷至高能軌道時吸收光波長不同 B H2O與NH3分子的空間構型不同 二者中心原子雜化軌道類型不同 C HF的熱穩定性比HCl強 H-F比H-Cl的鍵能大 D SiO2的熔點比干冰高 SiO2分子間的范德華力大 A.A B.B C.C D.D 組卷:29引用:1難度:0.5 -
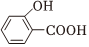
5.下列各組物質性質的比較,結論正確的是( )
A.在水中的溶解度:CH3CH2Br>CH3CH2OH B.沸點: 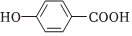 >
>
C.分子的極性:BCl3>NCl3 D.溶液酸性:CF3COOH<CCl3COOH 組卷:72引用:3難度:0.5 -
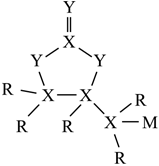 6.短周期主族元素R、X、Y、M原子序數依次增大,Y為地殼中含量最高的元素,M與Y元素不同周期且M原子的核外未成對電子數為1,由R、X、Y、M組成的物質結構式如圖所示,下列說法錯誤的是( )
6.短周期主族元素R、X、Y、M原子序數依次增大,Y為地殼中含量最高的元素,M與Y元素不同周期且M原子的核外未成對電子數為1,由R、X、Y、M組成的物質結構式如圖所示,下列說法錯誤的是( )A. 的空間結構為平面三角形XY2-3B.M的最高價氧化物對應的水化物為強酸 C.該化合物中X原子最外層均滿足8e-結構 D.Y元素所在周期中,第一電離能大于Y的元素有2種 組卷:107引用:6難度:0.6
二、非選擇題共58分
-
17.元素鈷位于周期表中的第四周期第Ⅷ族,常見的化合價有+2和+3價。科研人員設計在催化劑的作用下,利用濃氨水、氯化銨、雙氧水和CoCl2制備CoCl3?6NH3。實驗裝置如圖1:
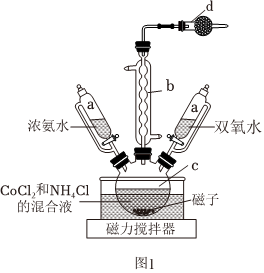
實驗步驟:
①首先將活性炭、CoCl2和氯化銨在儀器C中混合,再滴加濃氨水使溶液顏色變為黑紫色。
②置于冰水浴中冷卻至10℃以下,緩慢滴加雙氧水并不斷撈拌。
③轉移至60℃熱水浴中,恒溫加熱30min,同時緩慢攪拌。
④將反應后的混合物冷卻到0℃左右,抽濾得到CoCl3?6NH3粗產品。
⑤粗產品需要經過沸鹽酸溶解、趁熱過濾、再往濾液中慢慢加入10mL濃HCl,即有大量的橘黃色晶體析出,用冰水浴冷卻后抽濾。
⑥所得晶體用冷的濃鹽酸洗滌、再加少許____洗滌、烘干等操作得到較純CoCl3?6NH3。
已知:a.Co(OH)2開始沉淀pH=9。
b.CoCl3?6NH3為橘黃色晶體,難溶于乙醇。
請回答下列問題:
(1)儀器b的名稱為。
(2)儀器d中所盛藥品為,其作用主要為吸收揮發出來的氨氣。
(3)60℃恒溫加熱的優點是。
(4)步驟⑥中,再加少許洗滌。
(5)反應器中發生的總反應化學方程式為。
(6)取5.0mL0.01mol/LCoCl3?6NH3溶液和5.0mL0.01mol/LCoCl3?5NH3溶液,分別用濃度為0.01mol/LAgNO3溶液進行滴定,滴數傳感器記錄滴加AgNO3溶液的體積,電極電位傳感器測溶液電極電位的變化所得圖象如圖2,3: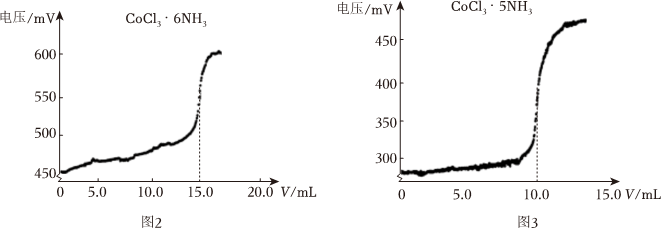
已知該配合物中Co3+的配位數為6,則CoCl3?6NH3用內界外界表示為,1molCoCl3?5NH3配合物中含有σ鍵的數目為。組卷:3引用:1難度:0.5 -
18.氟在已知元素中電負性最大、非金屬性最強,其單質在1886年才被首次分離出來。
(1)F-的核外電子排布式為O2F2 H2O2 O-O鍵長/pm 121 148 。
(2)氟氧化物O2F2、OF2的結構已經確定。
①依據數據推測O-O鍵的穩定性:O2F2H2O2(填“>”或“<”)。
②OF2中F-O-F鍵角小于H2O中H-O-H鍵角,解釋原因:。
(3)HF是一種有特殊性質的氫化物。
①已知:氫鍵(X-H???Y)中三原子在一條直線上時,作用力最強。測定結果表明,(HF)n固體中HF分子排列為鋸齒形,畫出含3個HF的結構片斷:。
②HF溶劑中加入BF3可以解離出和具有正四面體形結構的陰離子,寫出該過程的離子方程式:H2F+。
(4)工業上用繭石(主要成分CaF2)制備HF。CaF2晶體的一種立方晶胞如圖所示。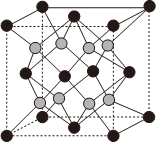
①CaF2晶體中距離Ca2+最近的Ca2+有個。
②晶體中Ca2+與F-的最近距離為dnm(1cm=107nm),阿伏加德羅常數值為NA。則該晶體的密度ρ=g?cm-3(列出計算式)。組卷:13引用:1難度:0.6


