2022-2023學年安徽師大附中高二(上)期中化學試卷
發(fā)布:2024/4/20 14:35:0
一、單項選擇題(每小題3分,共30分,每題只有一個選項符合題意)
-
1.下列說法正確的是( )
A.已知H+(aq)+OH-(aq)═H20(l)ΔH=-57.3kJ?mol-1,在中和熱的測定時實際加入的酸堿的量的多少會影響該反應的ΔH B.密閉容器中,9.6g硫粉與11.2g鐵粉混合加熱生成硫化亞鐵17.6g時,放出19.12kJ熱量。則Fe(s)+S(s)═FeS(s)ΔH=-95.6kJ?mol-1 C.500℃、30MPa下,將0.5molN2和1.5molH2置于密閉的容器中充分反應生成NH3(g),放熱19.3kJ,其熱化學方程式為:N2(g)+3H2(g)?2NH3(g)ΔH=-38.6k?Jmol-1 D.相同條件下,在兩個相同的恒容密閉容器中,2molN2和6molH2反應放出的熱量是1molN2和3molH2反應放出的熱量的2倍 組卷:27引用:4難度:0.7 -
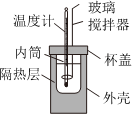 2.關(guān)于中和熱的測定實驗,下列說法正確的是( )
2.關(guān)于中和熱的測定實驗,下列說法正確的是( )A.為了簡化裝置,中和熱測定實驗中的玻璃攪拌器可以由溫度計代替 B.用醋酸代替鹽酸溶液進行上述實驗,測得的中和熱的ΔH偏小 C.實驗測定的中和熱的ΔH常常大于-57.3kJ?mol-1,原因可能是外部熱量進入裝置造成 D.中和熱測定實驗也可以用稀硫酸與氫氧化鈉溶液反應 組卷:15引用:3難度:0.7 -
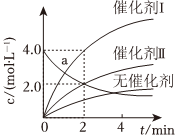 3.在相同條件下研究催化劑Ⅰ、Ⅱ?qū)Ψ磻猉→2Y的影響,各物質(zhì)濃度c隨反應時間t的部分變化曲線如圖,下列說法正確的是( )
3.在相同條件下研究催化劑Ⅰ、Ⅱ?qū)Ψ磻猉→2Y的影響,各物質(zhì)濃度c隨反應時間t的部分變化曲線如圖,下列說法正確的是( )A.無催化劑時,反應不能進行 B.使用催化劑Ⅰ時,0~2min內(nèi),v(X)=1.0mol?L-1?min-1 C.a(chǎn)曲線表示使用催化劑Ⅱ時X的濃度隨t的變化 D.與催化劑Ⅰ相比,催化劑Ⅱ使反應活化能更低 組卷:92引用:8難度:0.5 -
4.在反應4HCl+O2═2Cl2+2H2O中,已知2molO2被還原時,放出akJ的熱量,且斷開1 mol O2需要吸收b kJ的熱量,斷開1mol Cl2需要吸收c kJ的熱量.則斷開1mol H-0鍵比斷開1mol H-Cl鍵所需能量高( )
A. kJa+b-2c4B. kJa+2b-4c8C. kJb-a-2c4D. kJ2b-a-4c8組卷:25引用:5難度:0.7 -
5.下列有關(guān)合成氨工業(yè)的敘述,不可用勒夏特列原理來解釋的是( )
A.合成氨時采用循環(huán)操作,可提高原料的利用率 B.高壓比常壓條件更有利于合成氨的反應 C.低溫更有利于合成氨的反應 D.使用鐵觸媒,使N2和H2混合氣體有利于合成氨 組卷:6引用:1難度:0.7 -
6.Burns和Dainton研究發(fā)現(xiàn)Cl2與CO合成COCl2的反應機理如下:
①Cl2(g)=2Cl?(g)快
②CO(g)+Cl?(g)=COCl?(g)快
③COCl(g)+Cl2(g)=COCl2(g)+C?(g)慢
反應②的速率方程為v正=k正c(CO)×c(Cl),v逆=k逆c(COCl-)。
下列說法錯誤的是( )A.反應②的平衡常數(shù)K= k正k逆B.反應①的活化能小于反應③的活化能 C.要提高合成COCl2的速率,關(guān)鍵是提高反應②的速率 D.選擇合適的催化劑能提高單位時間內(nèi)COCl2的產(chǎn)率 組卷:25引用:1難度:0.6
三、填空題(本題共4小題,共50分)
-
18.在氮及其化合物的化工生產(chǎn)中,對有關(guān)反應的反應原理進行研究有著重要意義。
(1)一定溫度下,將2molN2和6molH2置于1L的恒容密閉容器中發(fā)生如下反應:
N2(g)+3H2(g)?2NH3(g) ΔH<0。測得不同溫度、不同時間段內(nèi)合成氨反應中N2的轉(zhuǎn)化率,數(shù)據(jù)如表:
①上表中T11小時 2小時 3小時 4小時 T1 30% 50% 80% 80% T2 35% 60% a b T2(填“>”或“<”或“=”),其中a、b、80%三者的大小關(guān)系是(用含“>”“<”“=”的關(guān)系式表示)。
②研究表明,合成氨的速率與相關(guān)物質(zhì)的濃度關(guān)系為v=kv(N2)(H2)c-1(NH3),k為速率常數(shù)。以下說法正確的是c32(填字母序號)。
A.升高溫度,k值增大
B.T2℃時若容器內(nèi)混合氣體平均相對分子質(zhì)量為12且保持不變,則反應達到平衡狀態(tài)
C.一定溫度下將原容器中的NH3及時分離出來可使v減小
D.合成氨達到平衡后,增大c(N2)可使正反應速率在達到新平衡的過程中始終增大。
③已知某溫度下該反應達平衡時各物質(zhì)均為1mol,容器容積為1L,保持溫度和壓強不變,又充入3molN2后,平衡(填“向左移動”“向右移動”或“不移動”)。
(2)在四個不同容積的恒容密閉容器中按圖甲充入相應的氣體,發(fā)生反應:2N2O(g)?2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡轉(zhuǎn)化率如圖乙所示:
①該反應的ΔH0(填“>”或“<”)。
②若容器Ⅰ的體積為2L,反應在370℃下進行,20s后達到平衡,則0~20s內(nèi)容器Ⅰ中用O2表示的反應速率為。B點對應的平衡常數(shù)K=(保留兩位有效數(shù)字)。
③圖中A、C、D三點容器內(nèi)氣體密度由大到小的順序是。
④若容器Ⅳ體積為1L,反應在370℃下進行,則起始時反應移動(填“向正反應方向”“向逆反應方向”或“不”)。組卷:82引用:3難度:0.3 -
19.煤的氣化是一種重要的制氫途徑,回答下列問題:
(1)在一定溫度下,向體積固定的密閉容器中加入足量的C(s)和1molH2O(g),起始壓強為0.2MPa時,發(fā)生下列反應生成水煤氣
Ⅰ.C(s)+H2O(g)?CO(g)+H2(g)ΔH1=+131.4kJ?mol-1
Ⅱ.CO(s)+H2O(g)?CO2(g)+H2(g)ΔH2=-41.1kJ?mol-1
①下列說法正確的是;
A.平衡時向容器中充入惰性氣體,反應Ⅰ的平衡逆向移動
B.混合氣體的密度保持不變時,說明反應體系已達到平衡
C.平衡時H2的體積分數(shù)可能大于23
D.將炭塊粉碎,可加快反應速率
②反應平衡時,H2O(g)的轉(zhuǎn)化率為50%,CO的物質(zhì)的量為0.1mol。此時,整個體系(填“吸收”或“放出”)熱量kJ,反應Ⅰ的平衡常數(shù)Kp=MPa(以分壓表示,分壓=總壓×物質(zhì)的量分數(shù))。
(2)摻雜硒的納米氧化亞銅催化劑可用于工業(yè)上水煤氣合成甲醇,其反應為CO(g)+2H2(g)?CH3OH(g)ΔH。向起始溫度為125℃的5L恒容密閉容器中充入2molCO和3molH2發(fā)生反應,體系總壓強(p)與時間(t)的關(guān)系如圖中曲線Ⅰ所示,曲線Ⅱ為只改變某一條件的變化曲線。平衡時溫度與起始溫度相同。
①曲線Ⅱ所對應的改變的條件可能為。
②體系總壓強先增大后減小的原因為。
③該條件下H2的平衡轉(zhuǎn)化率為%(結(jié)果保留三位有效數(shù)字)。組卷:23引用:1難度:0.5


