2020-2021學年寧夏吳忠中學高二(下)期中化學試卷
發布:2024/4/20 14:35:0
一、單選題(每題只有一個答案符合題意,每小題2分,共計50分)
-
1.以下能級符號正確的是( )
A.3f B.1p C.2d D.4s 組卷:46引用:6難度:0.9 -
2.中國科學技術名詞審定委員會已確定第116號元素Lv的名稱為鉝,質量數293.關于
Lv的敘述錯誤的是( )293116A.原子序數116 B.中子數177 C.核外電子數116 D.相對原子質量293 組卷:481引用:54難度:0.9 -
3.下列說法中不正確的是( )
A.處于最低能量的原子叫做基態原子 B.3p2表示3p能級有兩個電子 C.同一原子中,2p,3p,4p能級的軌道數依次增多 D.K+的電子排布式為1s22s22p63s23p6 組卷:7引用:1難度:0.6 -
4.下列有關光譜的說法中不正確的是( )
A.原子中的電子在躍遷時會發生能量的變化,能量的表現形式之一是光(輻射),這也是原子光譜產生的原因 B.原子只有發射光譜 C.通過原子光譜可以發現新的元素,也可以鑒定某些元素 D.霓虹燈光、激光、焰火都與電子躍遷釋放能量有關 組卷:18引用:2難度:0.6 -
5.8種常見元素的電負性數值如表所示,根據表中數據估算鈣元素的電負性的取值范圍( )
元素 Na Mg Al Si P S Cl K 電負性 0.9 1.2 1.5 1.8 2.1 2.5 3.0 0.8 A.小于0.8 B.大于1.2 C.在0.8與1.2之間 D.在0.9與1.5之間 組卷:6引用:4難度:0.6 -
6.已知短周期元素的離子aA2+、bB+、cC3-、dD-都具有相同的電子層結構,則下列敘述中正確的是( )
A.原子半徑:A>B>D>C B.原子序數:d>c>b>a C.離子半徑:C>D>B>A D.元素的第一電離能:A>B>D>C 組卷:108引用:8難度:0.9 -
7.下表為第三周期元素X和Y的各級電離能數據,單位是kJ?mol-1。下列判斷錯誤的是( )
電離能 I1 I2 I3 I4 I5 X元素 738 1451 7733 10540 13630 Y元素 578 1817 2745 11575 14830 A.X基態原子中能量最高能級的電子云輪廓圖為球形 B.X能與Cl形成化合物XCl2 C.X和Y在周期表中均屬于p區元素 D.Y與強酸和強堿均能反應產生氫氣 組卷:12引用:2難度:0.6 -
8.已知X、Y、Z、W、R是原子序數依次增大的短周期主族元素,X是周期表中原子半徑最小的元素,Y元素的最高正價與最低負價的絕對值相等,Z的核電荷數是Y的2倍,W的最外層電子數是最內層電子數的3倍.下列說法不正確的是( )
A.化合物YR4中各原子均滿足8電子穩定結構 B.對應的離子半徑:Z<R<W C.W與X、W與Y形成的化合物化學鍵類型完全相同 D.R的氧化物對應的水化物是強酸 組卷:11引用:2難度:0.5 -
9.下列關于σ鍵和π鍵的理解不正確的是( )
A.CH4中的化學鍵均是σ鍵 B.σ鍵可以繞鍵軸旋轉,π鍵一定不能繞鍵軸旋轉 C.碳碳雙鍵中有1個σ鍵、1個π鍵,碳碳三鍵中有1個σ鍵、2個π鍵 D.CH3-CH3、CH2=CH2、CH≡CH中的σ鍵都是C-C鍵 組卷:8引用:4難度:0.7 -
10.0.01molCrCl3?6H2O在水溶液中用過量硝酸銀溶液處理,生成0.02molAgCl沉淀。已知該CrCl3?6H2O中Cr3+形成六個配位鍵,則其結構是( )
A.[Cr(H2O)5Cl]Cl2?H2O B.[Cr(H2O)6]Cl3 C.[Cr(H2O)4Cl]Cl2?2H2O D.[Cr(H2O)3Cl3]Cl2?3H2O 組卷:5引用:1難度:0.8
二、填空題(共50分)
-
29.A、B、C、D、E代表前四周期原子序數依次增大的五種元素。A、D同主族且有兩種常見化合物DA2和DA3;工業上電解熔融C2A2制取單質C;B、E除最外層均只有2個電子外,其余各層全充滿,E位于元素周期表的ds區。回答下列問題:
(1)B、C中第一電離能較大的是(用元素符號填空),基態D原子價電子的軌道表達式為。
(2)DA2分子的VSEPR模型是。
(3)實驗測得C與氯元素形成化合物的實際組成為C2Cl4,其球棍模型如圖1所示。已知C2Cl4在加熱時易升華,與過量的NaOH溶液反應可生成Na[C(OH)4]。
①C2Cl4屬于晶體(填晶體類型),其中C原子的雜化軌道類型為雜化。
②[C(OH)4]-中存在的化學鍵有。
(4)B、C的氟化物晶格能分別是2957kJ?mol-1、5492kJ?mol-1,二者相差很大的原因是。
(5)D與E形成化合物晶體的晶胞如圖2所示: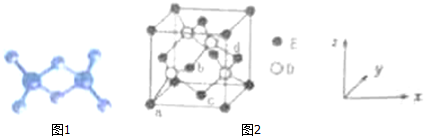
①在該晶胞中,E的配位數為。
②原子坐標參數可表示晶胞內部各原子的相對位置。上圖晶胞中,原子的坐標參數為a為(0,0,0);b(,0,12);c為(12,12,0)。則d原子的坐標參數為12。
③已知該晶胞的密度為ρg/cm3,則其中兩個D原子之間的距離為pm(列出計算式即可)。組卷:9引用:2難度:0.4 -
30.鎳是一種硬而有延展性并具有鐵磁性的金屬,且抗腐蝕,是重要的合金材料和催化劑。回答下列問題:
(1)基態鎳原子的價電子排布式為。
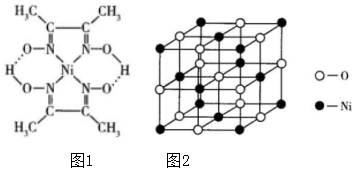
(2)Ni2+可以形成多種配離子,如[Ni(NH3)4]2+、[Ni(CN)4]2-、丁二酮肟鎳分子(如圖1)等。
①CN-中碳原子的雜化方式為,1mol[Ni(CN)4]2-中含有molσ鍵。
②[Ni(NH3)4]2+中H-N-H鍵角比NH3分子中H-N-H鍵角(填“大”或“小”),NH3極易溶于水的原因是。
③丁二酮肟鎳分子內含有的作用力有。(填字母)
a.配位鍵
b.離子鍵
c.氫鍵
d.范德華力
(3)NiO的晶胞結構如圖2所示,其密度是dg?cm-3,距離最近的兩個O2-之間的距離為cm。(用含d、NA的代數式表示,設NA表示阿伏加德羅常數的值)組卷:8引用:2難度:0.5


