2020年天津市和平區高考化學二模試卷
發布:2024/4/20 14:35:0
一、選擇題(本題包括12小題,每小題3分,共36分.每小題只有一個選項符合題意.)
-
1.手工制作工藝在我國有著悠久的歷史,是中華民族文化藝術的瑰寶。下列手工藝品用金 屬材料制成的是( )




A.北京糖人 B.山東面塑 C.蕪湖鐵畫 D.東陽木雕 A.A B.B C.C D.D 組卷:144引用:4難度:0.9 -
2.黨的十九大報告中多次提及“綠色”、“生態文明”。下列做法不應該提倡的是( )
A.分類放置生活廢棄物 B.實現化石燃料清潔利用 C.使用聚碳酸酯類可降解塑料 D.大量使用化肥、農藥提高糧食產量 組卷:41引用:4難度:0.6 -
3.下列物質放入水中發生化學反應,水作氧化劑的是( )
A.鈉 B.氯氣 C.氧化鈣 D.過氧化鈉 組卷:70引用:1難度:0.8 -
4.下列化學用語對事實的表述錯誤的是( )
A.氯原子的結構示意圖: 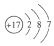
B.羰基硫(COS)的結構式為O=C=S C.  為Si原子的一種激發態
為Si原子的一種激發態D.中子數為10的氧原子形成的過氧根離子: O22-108組卷:62引用:4難度:0.8 -
5.下列有關說法不正確的是( )
A.向Mg(OH)2加入足量稀硫酸,加熱濃縮,冷卻結晶后得到硫酸鎂晶體 B.氨水清除試管壁附著的銀鏡 C.可用稀硝酸鑒別MgI2、AgNO3、Na2CO3、NaAlO2四種溶液 D.除去乙酸乙酯中的乙酸雜質,加入碳酸鈉溶液,分液 組卷:82引用:2難度:0.7
二、非選擇題(共64分)注意事項:第Ⅱ卷共4頁,用藍、黑色墨水的鋼筆或圓珠筆直接答在答題紙上.相對原子質量:H1C12N14O16Na23Al27S32Cl35.5K39Fe56
-
 15.實驗室以次氯酸鹽和鐵鹽為原料制備少量K2FeO4的操作步驟如下:
15.實驗室以次氯酸鹽和鐵鹽為原料制備少量K2FeO4的操作步驟如下:
Ⅰ.制備NaClO強堿性飽和溶液:
①將20mL NaOH溶液加入儀器b中,冷水浴冷卻,通入Cl2,攪拌,直至溶液變為黃綠色且有少量白色晶體析出為止(裝置如圖所示)。
②將所得飽和NaClO倒入燒杯并置于冷水浴中,分幾次加入20g NaOH固體并不斷攪拌,過濾,得NaClO強堿性飽和溶液。
(1)甲裝置中a管的作用是。
(2)寫出甲裝置中反應的化學方程式。
(3)石灰乳的作用是。
(4)反應過程中用冷水浴冷卻的原因是。
Ⅱ.合成K2FeO4:
①稱取5.05g Fe(NO3)3?9H2O(相對分子質量為404)固體,在冷水浴中分批加入Ⅰ中所得濾液,并不斷攪拌,反應1小時后溶液呈深紫紅色(即Na2FeO4)。
②離心分離除去Na2FeO4水解得到的Fe(OH)3膠體,留上層清液(深紫紅色)。
③向②的上層清液中緩慢加入KOH飽和溶液50.00mL,冰水浴保持5min,過濾,得K2FeO4(相對分子質量為198)粗產品。
④將粗產品重結晶,并用異丙醇洗滌,低溫烘干,得純產品2.13g。
(5)合成Na2FeO4的離子方程式為。
(6)過程③加入飽和KOH溶液即可得到K2FeO4粗產品,原因是。
(7)用異丙醇洗滌的目的是。
(8)K2FeO4的產率為。(保留至0.1%)。組卷:197引用:2難度:0.5 -
16.節能和減排建設友好型社會的必然選擇。回答下列問題:
(1)已知在一定溫度下,①C(s)+CO2(g)?2CO(g)△H1=akJ?mol-1平衡常數K1。
②CO(g)+H2O(g)?H2(g)+CO2(g)△H2=bkJ?mol-1平衡常數K2。
某反應的平衡常數表達式K3=,請寫出此反應的熱化學方程式c(CO)?c(H2)c(H2O),K1、K2、K3之間的關系是。
(2)將原料氣按n(CO2):n(H2)=1:4置于密閉容器中發生CO2(g)+4H2(g)?CH4(g)+2H2O(g)反應,測得H2O(g)的物質的量分數與溫度的關系如圖1所示: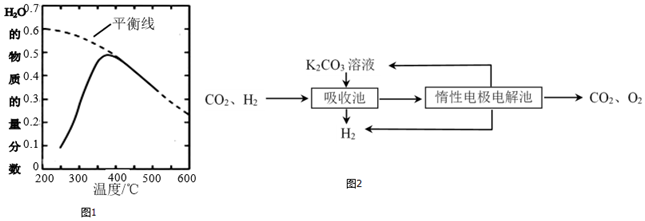
①該反應的平衡常數K隨溫度降低而(填“增大”或“減小”)。
②在密閉恒溫(高于100℃)恒容裝置中進行該反應,達到平衡狀態的是。
a.混合氣體密度不再改變
b.混合氣體壓強不再改變
c.混合氣體平均摩爾質量不再改變
d.n(CO2):n(H2)=1:2
③200℃達到平衡時體系的總壓強為P,該反應平衡常數Kp的計算表達式為(不必化簡,用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。
(3)500℃時,CO與水反應生成CO2和H2,將其分離得到H2的過程示意圖如圖2:
①陽極反應式是。
②結合電極反應式,簡述K2CO3溶液的再生原理。組卷:71引用:1難度:0.5


