2022-2023學年福建省莆田一中高三(上)期中化學試卷
發布:2024/9/6 1:0:8
一、單項選擇題(共15小題,每小題3分,滿分45分)
-
1.下列分別是利用不同能源發電的實例圖形,其中不屬于新能源開發利用的是( )
A. 
風力發電B. 
太陽能發電C. 
火力發電D. 
潮汐能發電組卷:126引用:29難度:0.9 -
2.以下過程在常溫下都可以自發進行,可用焓判據來解釋的是( )
A.硝酸銨自發地溶于水 B.濕的衣服經過晾曬變干 C.2N2O5(g)═4NO2(g)+O2(g)△H=+56.7kJ/mol D.2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol 組卷:46引用:4難度:0.7 -
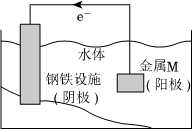 3.為減緩鋼鐵設施在如圖所示的情境中腐蝕速率,下列說法正確的是( )
3.為減緩鋼鐵設施在如圖所示的情境中腐蝕速率,下列說法正確的是( )A.此裝置設計符合電解池的工作原理 B.金屬M的還原性應該比Fe的還原性弱 C.當水體環境呈較強酸性時,鋼鐵設施表面會有氣泡冒出 D.當水體環境呈中性時,發生的反應有O2-4e-+2H2O═4OH- 組卷:187引用:7難度:0.4 -
4.室溫下向10mL0.1mol/L的氨水中加水稀釋后,下列說法正確的是( )
A.溶液中導電離子的數目減少 B.NH3?H2O的電離程度增大,c(OH-)亦增大 C.溶液中 增大c(NH4+)c(NH3?H2O)D.向氨水中加入NH4Cl固體,NH3?H2O的電離平衡逆向移動,c( )減小NH+4組卷:127引用:7難度:0.6 -
5.下列事實不能用勒夏特列原理解釋的是( )
A.新制的氯水在光照條件下顏色變淺 B.合成氨工業中使用鐵觸媒作催化劑 C.紅棕色的NO2氣體,加壓后顏色先變深后變淺 D.工業生產硫酸的過程中,通入過量的空氣以提高二氧化硫的轉化率 組卷:21引用:5難度:0.6 -
6.可逆反應:2NO2(g)?2NO(g)+O2(g)在一固定容積的密閉容器中反應,達到平衡狀態的標志是( )
①單位時間內生成nmolO2的同時生成2nmolNO;
②單位時間內生成nmolO2的同時生成2nmolNO2;
③用NO2、NO、O2物質的量濃度變化表示的反應速率的比為2:2:1的狀態;
④混合氣體的顏色不再改變的狀態;
⑤混合氣體的密度不再改變的狀態。A.②④⑤ B.①④ C.②④ D.①②③④⑤ 組卷:5引用:2難度:0.7
二、填空題(共4小題,滿分52分)
-
18.完成下列問題。
(1)某同學探究影響硫代硫酸鈉與稀硫酸(Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O)反應速率的因素時,設計如下系列實驗:
實驗①、②可探究實驗序號 反應溫度/℃ Na2S2O3溶液 稀H2SO4 H2O V/mL c/(mol/L) V/mL c/(mol/L) V/mL ① 20 10.0 0.10 10.0 0.50 0 ② 40 V1 0.10 V2 0.50 V3 ③ 20 V4 0.10 4.0 0.50 V5 對反應速率的影響,因此V3是;實驗①、③可探究對反應速率的影響,因此V5是。
(2)①I-可以作為水溶液中SO2歧化反應的催化劑,可能的催化過程如下。將Ⅱ補充完整。
Ⅰ.SO2+4I-+4H+═S↓+2I2+2H2O
Ⅱ.I2+2H2O+═++2I-
②探究Ⅰ、Ⅱ反應速率與SO2歧化反應速率的關系,實驗如下:分別將18mLSO2飽和溶液加入到2mL下列試劑中,密閉放置觀察現象。(已知:I2易溶解在KI溶液中)
ⅰ.B是A的對比實驗,則a═序號 A B C D 試劑組成 0.4mol?L-1KI amol?L-1KI
0.2mol?L-1H2SO40.2mol?L-1H2SO4 0.2mol?L-1KI
0.0002molI2實驗現象 溶液變黃,一段時間后出現渾濁 溶液變黃,出現渾濁較A快 無明顯現象 溶液由棕褐色很快褪色,變成黃色,出現渾濁較A快 。
ⅱ.比較A、B、C,可得出的結論是。
A.I-可以作為SO2歧化反應的催化劑
B.增強溶液酸性可以加快SO2的歧化反應
C.氫離子單獨存在對SO2歧化反應無明顯影響
ⅲ.實驗表明,SO2的歧化反應速率D>A。結合Ⅰ、Ⅱ反應速率解釋原因:。組卷:7引用:4難度:0.7 -
19.我國力爭于2030年前做到碳達峰,2060年前實現碳中和。CH4與CO2重整是CO2利用的研究熱點之一。該重整反應體系主要涉及以下反應:
a)CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1
b)CO2(g)+H2(g)?CO(g)+H2O(g)△H2
c)CH4(g)?C(s)+2H2(g)△H3
d)2CO(g)?CO2(g)+C(s)△H4
e)CO(g)+H2(g)?H2O(g)+C(s)△H5
(1)根據蓋斯定律,反應a的△H1=( 寫出一個代數式即可)。
(2)上述反應體系在一定條件下建立平衡后,下列說法正確的有。
A.增大CO2與CH4的濃度,反應a、b、c的正反應速率都增加
B.移去部分C(s),反應c、d、e的平衡均向右移動
C.加入反應a的催化劑,可提高CH4的平衡轉化率
D.降低反應溫度,反應a~e的正、逆反應速率都減小
(3)一定條件下,CH4分解形成碳的反應歷程如圖1所示。該歷程分步進行,其中,第步的正反應活化能最大。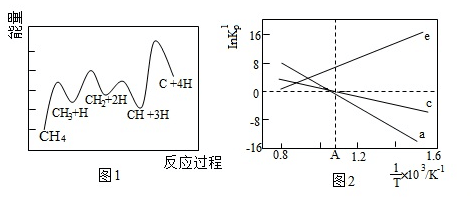
(4)設K為相對壓力平衡常數,其表達式寫法:在濃度平衡常數表達式中,用相對分壓代替濃度。氣體的相對分壓等于其分壓(單位為kPa)除以p0(p0=100kPa)。反應a、c、e的InKrp隨rp(溫度的倒數)的變化如圖2所示。1T
①反應a、c、e中,屬于吸熱反應的有(填字母)。
②反應c的相對壓力平衡常數表達式為K=rp。
③在圖2中A點對應溫度下、原料組成為n(CO2):n(CH4)=1:1、初始總壓為100kPa的恒容密閉容器中進行反應,體系達到平衡時H2的分壓為40kPa。計算CH4的平衡轉化率,寫出計算過程。
(5)CO2用途廣泛,寫出基于其物理性質的一種用途:。組卷:930引用:5難度:0.5


