2020-2021學年北京交大附中高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(共14小題,每小題3分,滿分42分)
-
1.化學與生活密切相關,下列說法錯誤的是( )
A.碳酸鈉可用于去除餐具的油污 B.氯化銨可用于鐵制品的除銹劑 C.氫氧化鋁可用于中和過多胃酸 D.碳酸鋇可用于胃腸X射線造影檢查 組卷:78引用:10難度:0.7 -
2.下列溶液一定呈中性的是( )
A.CuCl2溶液 B.NaHCO3溶液 C.NaNO3溶液 D.NH4Cl和NH3??H2O混合溶液 組卷:20引用:1難度:0.7 -
3.反應A+3B═4C+2D,在不同條件下反應,其平均反應速率v(X)(表示反應物的消耗速率或生成物的生成速率)如下,其中反應速率最快的是( )
A.v(A)=0.4mol/(L?s) B.v(B)=0.8mol/(L?s) C.v(C)=1.2mol/(L?s) D.v(D)=0.7mol/(L?s) 組卷:81引用:10難度:0.9 -
4.在抗擊新冠肺炎的過程中,科研人員研究了法匹拉韋、利巴韋林、氯硝柳胺等藥物的療效,三種藥物主要成分的結構簡式如圖。下列說法不正確的是( )

A.X的分子式為C5H4O2N3F B.Z中含有4種官能團 C.Y和Z都有羥基 D.X和Z都屬于芳香族化合物 組卷:23引用:1難度:0.7 -
5.最近《科學》雜志評出“十大科技突破”,其中“火星上‘找’到水的影子”名列第一。下列關于水的說法中正確的是( )
A.加入電解質一定會破壞水的電離平衡,其中酸和堿通常都會抑制水的電離 B.水的電離和電解都需要電,常溫下都是非自發過程 C.水電離出的c(H+)=10-7mol/L的溶液一定呈中性 D.水的離子積不僅只適用于純水,升高溫度一定使水的離子積增大 組卷:58引用:2難度:0.7 -
6.水煤氣變換反應為:CO(g)+H2O(g)═CO2(g)+H2(g)。我國學者結合實驗與計算機模擬結果,研究了在金催化劑表面上水煤氣變換的反應歷程,如圖所示,其中吸附在金催化劑表面上的物種用●標注。下列說法正確的是( )

A.水煤氣變換反應的△H>0 B.步驟③的化學方程式為:CO●+OH●+H2O(g)═COOH●+H2O● C.步驟⑤只有非極性鍵H-H鍵形成 D.該歷程中最大能壘(活化能)E正=1.70eV 組卷:158引用:12難度:0.8
二、解答題(共6小題,滿分58分)
-
19.某小組探究酸化條件對0.1mol/L KI溶液氧化反應的影響。
(1)溶液變藍,說明溶液中含有序號 操作及現象 實驗1 取放置一段時間后依然無色的0.1mol/L KI溶液,加入淀粉溶液,溶液不變藍;向溶液中繼續加入2滴6mol/L的稀硫酸,溶液立即變藍 實驗2 取新制的0.1mol/L KI溶液,加入淀粉溶液,溶液不變藍;向溶液中繼續加入2滴6mol/L的稀硫酸,溶液10s后微弱變藍 。結合實驗1和實驗2,該小組同學認為酸化能夠加快I-氧化反應的速率。
(2)同學甲對滴加稀硫酸后溶液變藍速率不同的原因提出猜想:放置一段時間后的0.1mol/L KI溶液成分與新制0.1mol/L KI溶液可能存在差異,并繼續進行探究。
實驗3:取新制0.1mol/L KI溶液在空氣中放置,測得pH如表。
資料:時間 5分鐘 1天 3天 10天 pH 7.2 7.4 7.8 8.7
ⅰ.pH<11.7時,I-能被O2氧化為I2。
ⅱ.一定堿性條件下,I2容易發生歧化,產物中氧化產物與還原產物的物質的量之比為1:5。
①用化學用語,解釋0.1mol/L KI溶液放置初期pH升高的原因:。
②對比實驗1和實驗2,結合化學用語和必要的文字,分析實驗1中加稀硫酸后“溶液立即變藍”的主要原因可能是。
(3)同學甲進一步設計實驗驗證分析的合理性。
(4)該組同學想進一步探究pH對I2發生歧化反應的影響,進行了如下實驗。序號 操作 現象 實驗4 重復實驗2操作后,繼續向溶液中加入 。溶液立即變藍
信息:反應中若氧化作用和還原作用發生在同一分子內部處于同一氧化態的元素上,使該元素原子(或離子)一部分被氧化,另一部分被還原,則這種自身的氧化還原反應被稱為歧化反應。
實驗5:用20mL 4種不同濃度的KOH溶液與2mL淀粉溶液進行混合,測量混合液的pH后,向其中加入2滴飽和碘水,觀察現象。記錄如表。
①從實驗5可以看出pH越大,歧化反應速率越實驗組 A B C D pH 11.4 10.6 9.5 8.4 現象 無顏色變化 產生藍色后瞬間消失 產生藍色,30s后藍色消失 。(填“快”或“慢”)
②解釋pH=8.4時,“產生藍色,30s后藍色消失”的原因:。組卷:36引用:1難度:0.6 -
 20.某實驗小組對KSCN的性質進行探究,設計如下實驗:
20.某實驗小組對KSCN的性質進行探究,設計如下實驗:
(1)SCN-存在兩種結構式,分別為N≡C-S-和S=C=N-,SCN-是二者的互變異構的混合物,請寫出N≡C-S-的電子式試管中試劑 實驗 滴加試劑 現象 
2mL 0.1mol/L
KSCN溶液Ⅰ ⅰ.先加1mL 0.1mol/L FeSO4溶液
ⅱ.再加硫酸酸化的KMnO4溶液ⅰ.無明顯現象
ⅱ.先變紅,后褪色Ⅱ ⅲ.先加1mL 0.05mol/L Fe2(SO4)3溶液
ⅳ.再滴加0.5mL 0.5mol/L FeSO4溶液ⅲ.溶液變紅
ⅳ.紅色明顯變淺。
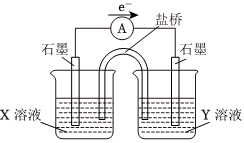
(2)①用離子方程式表示實驗Ⅰ溶液變紅的原因。
②針對實驗中紅色褪去的原因,小組同學認為是SCN-被酸性KMnO4氧化為,并設計如圖實驗裝置證實了猜想是成立的。其中Ⅹ溶液是SO2-4,Y溶液是,檢驗產物的操作及現象是SO2-4。
(3)針對實驗Ⅱ“紅色明顯變淺”的現象,實驗小組進行探究。
甲同學查資料得知:當加入強電解質后,增大了離子問相互作用,離子之間牽制作用增強,即“鹽效應”。“鹽效應使Fe3++SCN-?[Fe(SCN)]2+平衡體系中的Fe3+跟SCN-結合成[Fe(SCN)]2+的機會減少,溶液紅色變淺。
乙同學認為SCN可以與Fe反應生成無色絡合離子,進一步使Fe3++SCN-?[Fe(SCN)]2+平衡左移,紅色明顯變淺,而Mg2+與SCN-難絡合,于是乙設計了如下實驗: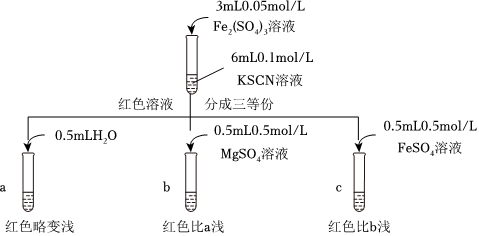
由此推測,實驗Ⅱ“紅色明顯變淺”的原因是。
(4)工業上測定鈦鐵合金中鈦含量的其中一步反應原理是:以KSCN為指示劑,用NH4Fe(SO4)2標準溶液滴定Ti(Ⅲ),反應的化學方程式為:Ti2(SO4)3+2NH4Fe(SO4)2═2Ti(SO4)2+(NH4)2SO4+2FeSO4,則達到滴定終點的實驗現象是。組卷:50引用:3難度:0.9


