2022-2023學年江蘇省揚州市寶應縣九年級(上)期中化學試卷
發布:2024/8/1 8:0:9
一、單項選擇題(本題包括20小題,每小題2分.每小題只有一個選項符合題意.)
-
1.“構建生命共同體”體現人與自然和諧共生。下列說法與該理念不相符的是( )
A.全民義務植樹活動 B.大肆開采礦物資源 C.生活廢水處理排放 D.長江流域十年禁漁 組卷:117引用:21難度:0.7 -
2.“神舟十三號”執行的下列任務中,一定涉及化學變化的是( )
A.出艙行走 B.展示國旗 C.采集水樣 D.點火返回 組卷:211引用:24難度:0.4 -
3.下列各組物質中,前者是化合物,后者是混合物的是( )
A.凈化后的空氣、雪碧飲料 B.冰水混合物、澄清石灰水 C.汽水、高錳酸鉀 D.液態氧、液態空氣 組卷:236引用:15難度:0.7 -
4.比較是一種重要的學習方法。下列有關比較正確的是( )
A.電子數:硫原子>硫離子 B.空氣中含量:氧氣>氮氣 C.溶解性:氧氣>二氧化碳 D.水蒸氣含量:呼出氣體>吸入空氣 組卷:27引用:3難度:0.7 -
5.2021年10月16日神舟十三號載人飛船發射成功,開始中國迄今為止時間最長的載人飛行。太空艙里常用NiFe2O4作催化劑將航天員呼出的CO2轉化為O2。已知NiFe2O4中Fe為+3價,則Ni的化合價為( )
A.+1 B.+2 C.+3 D.+4 組卷:206引用:19難度:0.4 -
6.下列物質由分子構成的是( )
A.氯化鈉 B.金屬銅 C.金剛石 D.干冰 組卷:46引用:25難度:0.7 -
7.下列關于催化劑的說法不正確的是( )
A.任何化學 反應都需要催化劑 B.化學反應前后,催化劑的質量和化學性質都不變 C.催化劑可以提高某些化學反應的速率 D.催化劑不能改變生成物的質量 組卷:25引用:3難度:0.7 -
8.下列圖標中屬于消防安全標志的是( )

A.①③⑤ B.③④⑤ C.①② D.②④ 組卷:398引用:10難度:0.7
二、非選擇題(共60分)
-
24.某小組同學做鎂在空氣中燃燒的實驗時,仔細觀察發現生成物中有少許黑色固體,針對這一現象,進行了以下實驗探究。
【探究目的】
(1)。
【實驗一】鎂與氧氣的反應
將鎂帶打磨,點燃,伸入盛滿氧氣的集氣瓶中,產生大量白煙,生成白色固體。
(2)點燃前,用砂紙打磨鎂帶的目的是。
(3)寫出該反應的化學方程式:。
實驗結論:鎂與氧氣反應生成白色的氧化鎂。
【實驗二】鎂與氮氣的反應
(4)獲取氮氣:
分離空氣的常用方法是將空氣液化后再氣化。液態空氣氣化時首先分離出氮氣,則沸點:N2O2(選填“高于”、“等于”或“低于”)。
打磨鎂帶至光亮,點燃,伸入盛氮氣的集氣瓶中,瓶內壁附著一層淡黃色的固體。
實驗結論:鎂與氮氣在點燃的條件下反應生成淡黃色的氮化鎂(Mg3N2)。
【實驗三】鎂與水蒸氣的反應
實驗裝置如圖所示: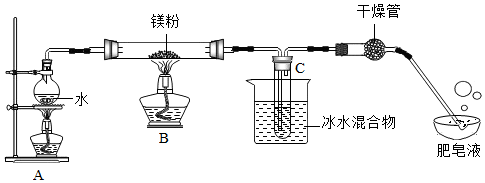
(5)實驗開始時,應先點燃A處酒精燈,等觀察到水沸騰一段時間后,再點燃B處酒精燈,這樣做的目的是。
(6)生成的氣體通入肥皂液中,用燃著的木條靠近肥皂泡,有爆鳴聲,稍后有肥皂泡飄到空中,說明生成的氣體是(填化學符號)。
實驗結論:鎂粉能和水蒸氣反應,但裝置B中并沒有產生黑色固體。
【實驗四】鎂與二氧化碳的反應
(7)把燃著的鎂條插入二氧化碳的集氣瓶中劇烈燃燒,發現在白煙中夾雜著大量黑色物質,該反應的化學方程式為。
【探究結論】鎂在空氣中燃燒的實驗時,生成物中少許黑色固體是碳。
【實驗反思】
(8)本探究活動同學們對可燃物的燃燒有了新的認識,燃燒需要氧氣(填“一定”或“不一定”)。
(9)通過本次探究,我們知道鎂能與氮氣反應生成淡黃色的氮化鎂(Mg3N2)固體。但在空氣中燃燒鎂條時很難觀察到生成物中有淡黃色固體,原因是。組卷:47引用:2難度:0.5 -
 25.如圖為實驗室盛有碳酸鈣試劑瓶的標簽。
25.如圖為實驗室盛有碳酸鈣試劑瓶的標簽。
(1)①碳酸鈣由種元素組成。
②碳酸鈣中鈣、氧、碳各元素的質量比為,碳酸鈣中碳元素的質量分數是。
(2)為了測定一批石灰石樣品中碳酸鈣的質量分數,進行如下實驗(樣品中除碳酸鈣外,其余的成分既不與鹽酸反應,也不溶于水),實驗與所得的數據如下表:
(每次取用的石灰石樣品的質量相同,稀鹽酸質量分數也相同)
①計算上述表格中的m值實驗 第一次 第二次 第三次 石灰石樣品的質量/g m m m 稀鹽酸的質量/g 40 80 120 剩余固體的質量/g 6 2 1 ;
②實驗中碳酸鈣的質量分數是;
③第一次實驗結束產生二氧化碳的質量是g(保留2位小數)。組卷:28引用:1難度:0.5


