2021-2022學年西藏昌都市第三高級中學高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每題3分,共48分,每題只有一個選項符合題意)
-
1.化學與生活密切相關,下列說法正確的是( )
A.中國天眼傳輸信息用的光纖材料是硅 B.碳酸鋇可用于胃腸X射線造影檢查 C.陶瓷是應用較早的人造材料,主要化學成分是硅酸鹽 D.綠色化學的核心是應用化學原理對環境污染進行治理 組卷:4引用:1難度:0.9 -
2.已知NA是阿伏加德羅常數的值,下列說法錯誤的是( )
A.3g3He含有的中子數為1NA B.標況下,22.4L氨水含有NA個NH3分子 C.1molNH4+中含有的電子數為10NA D.1molCH2=CH2分子中含有的共價鍵數為6NA 組卷:3引用:1難度:0.6 -
3.用H2O2和H2SO4的混合溶液可溶出廢舊印刷電路板上的銅。已知:
①Cu(s)+2H+(aq)═Cu2+(aq)+H2(g) ΔH1=+64.39kJ?mol-1
②2H2O2(l)═2H2O(l)+O2(g) ΔH2=-196.46kJ?mol-1
③H2(g)+O2(g)═H2O(1)ΔH3=-285.84kJ?mol-112
在H2SO4溶液中,1molCu(s)與H2O2(l)反應生成Cu2+(aq)和H2O(l)的反應熱ΔH等于( )A.-319.68kJ?mol-1 B.-417.91kJ?mol-1 C.-448.46kJ?mol-1 D.+546.69kJ?mol-1 組卷:45引用:4難度:0.6 -
4.下列有關能源的理解或說法錯誤的是( )
A.研發開采可燃冰水合甲烷的技術,可大大緩解能源危機 B.乙醇是一種可再生能源,可代替汽油作為汽車燃料 C.氫氣是最輕的燃料,是具有廣闊發展前景的能源 D.煤、石油、太陽能、風能等均屬于新能源 組卷:2引用:1難度:0.8 -
5.下列有關熱化學方程式,書寫正確的是( )
以知條件 熱化學方程式 A 中和熱為57.3kJ/mol Ba(OH)2(aq)+H2SO4(aq)═BaSO4(s)+2H2O(l)△H=-114.6kJ/mol B 合成氨反應生成0.1mol氨氣時放出akJ熱量 N2(g)+3H2(g)═2NH3(g) ΔH=-20akJ/mol C 氫氣的燃燒熱為285.8kJ/mol H2(g)+ O2(g)═H2O(g) ΔH=-285.8kJ/mol12D 碳的燃燒熱為393.5kJ/mol 2C(s)+O2(g)═2CO(g) ΔH=-787kJ/mol A.A B.B C.C D.D 組卷:6引用:1難度:0.7 -
6.下列說法中正確的是( )
A.中和熱測定實驗時,如果沒有環形玻璃攪拌棒,可用環形銅質攪拌棒代替 B.實驗室制取氯氣時用排水法或向上排空氣法收集氣體 C.NO2球放在熱水中的顏色加深,放入冷水中的顏色變淺 D.用pH試紙測定溶液的pH值時,先把試紙放在待測液中,然后比色 組卷:0引用:1難度:0.7
二、非選擇題(共52分)
-
19.研究CO還原NOx對環境的治理有重要意義,相關的主要化學反應有:
Ⅰ.NO2(g)+CO(g)?CO2(g)+NO(g) ΔH1
Ⅱ.2NO2(g)+4CO(g)?N2(g)+4CO2(g) ΔH2<0
Ⅲ.2NO(g)+2CO(g)?N2 (g)+2CO2 (g) ΔH3<0
(1)已知:每1mol下列物質分解為氣態基態原子吸收的能量分別為
①根據上述信息計算ΔH1=NO2 CO CO2 NO 819kJ 1076kJ 1490kJ 632kJ kJ?mol-1。
②下列描述正確的是。
A.在絕熱恒容密閉容器中只進行反應Ⅰ,若壓強不變,能說明反應Ⅰ達到平衡狀態
B.反應ⅡΔH<0,ΔS<0;該反應在低溫下自發進行
C.恒溫條件下,增大CO的濃度能使反應Ⅲ的平衡向正向移動,平衡常數增大
D.上述反應達到平衡后,升溫,三個反應的逆反應速率均一直增大直至達到新的平衡
(2)德國化學家F?Haber從1902年開始研究N2和H2直接合成NH3.在1.01×105Pa、250℃時,將1molN2和1molH2加入aL剛性容器中充分反應,測得NH3體積分數為4%,其他條件不變,溫度升高至450℃,測得NH3體積分數為2.5%,則可判斷合成氨反應△H0(填“>”或“<”)。
(3)在2L密閉絕熱容器中,投入4molN2和6molH2,在一定條件下生成NH3,測得不同溫度下,平衡時NH3的物質的量數據如下表:
①下列能說明該反應已達到平衡狀態的是溫度/K T1 T2 T3 T4 n(NH3)/mol 3.6 3.2 2.8 2.0 。
A.3v正(H2)=2v逆(NH3)
B.容器內氣體壓強不變
C.混合氣體的密度不變
D.混合氣的溫度保持不變
②溫度T1T3 (填“>”“<”或“=”)。
③在T3溫度下,達到平衡時N2的體積分數。
(4)T℃時,在恒溫恒容的密閉條件下發生反應:N2(g)+3H2(g)?2NH3(g),反應過程中各物質濃度的變化曲線如圖所示: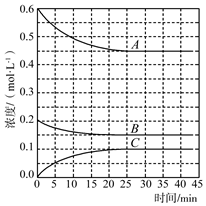
①表示H2濃度變化的曲線是(填“A”、“B”或“C”)。
②在0~25min內N2的平均反應速率為。組卷:5引用:1難度:0.7 -
20.用如圖所示的裝置來測定鎂與硫酸反應的速率,在錐形瓶中加入0.7克鎂帶(已打磨光亮),按如圖連接好裝置,從A中加入20.0mL0.5mol/LH2SO4。記錄注射器活塞的位置和相應的時間。記錄數據如下:
(1)儀器A的名稱是時間/s 0 t 2t ?????? 
活塞的位置/mL 17.3 25.6 36.6 ?????? ,其使用前必須進行的操作是。
(2)0~t時間段與t~2t時間段,化學反應速率最快的是時間段,原因是。
(3)用上述裝置探究Fe3+、Cu2+對雙氧水分解速率的影響,所用試劑:5%H2O2、0.1mol/LFeCl3、0.2mol/LCuCl2。完成表的實驗設計:
上表中需要添加的物質是實驗序號 雙氧水體積/mL 蒸餾水體積/mL 添加的物質 I 10 0 mLFeCl32 10 2 2mLCuCl2 mLFeCl3溶液。
(4)查閱資料,FeCl3溶液和CuCl2溶液都能對H2O2分解起催化作用,起作用的微粒分別是Fe3+和Cu2+,且Fe3+比Cu2+催化效果更好。設計實驗證實這種說法的正確性。
試管乙中滴加的試劑試管 甲 乙 丙 盛裝試劑 10mL5%H2O2 10mL5%H2O2 10mL5%H2O2 滴加試劑 5滴0.1mol/LFeCl3溶液 5滴 溶液5滴0.3mol/LNaCl 溶液 產生氣泡情況 較快產生細小氣泡 緩慢產生細小氣泡 無氣泡產生 ,進行丙試管實驗的目的。組卷:1引用:1難度:0.6


