2023-2024學年北京師大附屬實驗中學高三(上)開學化學試卷
發布:2024/8/26 4:0:8
一、本部分共14題,每題3分,共42分。在每題列出的四個選項中,選出最符合題目要求的一項。
-
1.下列化學用語正確的是( )
A.羥基的電子式: 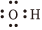
B.聚丙烯的結構簡式: 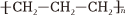
C.Ga的價層電子排布:4s24p1 D.水分子的充填模型:  組卷:11引用:2難度:0.7
組卷:11引用:2難度:0.7 -
2.NA為阿伏加德羅常數,下列說法正確的是( )
A.3.2gO2和O3的混合物中含有的氧原子數目為0.2NA B.1mol金剛石中含有的共價鍵數為4NA C.標準狀況下,11.2L水中含有的氧原子數為0.5NA D.2.0mol/L硫酸溶液中含有的硫酸根離子數目為2NA 組卷:27引用:3難度:0.7 -
3.根據元素周期律判斷,不正確的是( )
A.Mg原子失電子能力比Ca弱 B.K與水反應比Mg與水反應劇烈 C.HCl的穩定性強于HBr D.H3PO4酸性強于H2SO4 組卷:8引用:3難度:0.8 -
4.元素周期表中的五種元素A、B、E、W、Z,原子序數依次增大。A的基態原子價層電子排布為nsnnpn;B的基態原子最外層有3個單電子;E的原子最外層電子數是其內層的3倍,W和E位于同一族;Z3+的3d軌道中有5個電子。下列說法正確的是( )
A.第一電離能:I1(E)>I1(B)>I1(A) B.A單質的晶體都屬于共價晶體 C.E的單質可將W從它的氫化物中置換出來 D.單質Z和稀硫酸反應的離子方程式為:2Z+6H+=2Z3++3H2↑ 組卷:25引用:2難度:0.5 -
5.下列各組變化,所克服的粒子間作用屬于同種類型的是( )
A.Na2O2和SiO2熔化 B.Mg和S熔化 C.氯化鉀和蔗糖熔化 D.碘和干冰升華 組卷:6引用:2難度:0.7 -
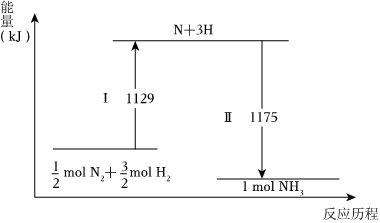 6.N2(g)與H2(g)在鐵催化劑表面經歷如圖過程生成NH3(g),下列說法不正確的是( )
6.N2(g)與H2(g)在鐵催化劑表面經歷如圖過程生成NH3(g),下列說法不正確的是( )A.Ⅰ過程中破壞的均為非極性鍵 B.Ⅰ過程吸收能量,Ⅱ過程放出能量 C.氨分解的熱化學方程式為2NH3(g)?N2(g)+3H2(g)ΔH=+92kJ?mol-1 D.使用催化劑可以降低反應的焓變,從而提高化學反應速率 組卷:42引用:2難度:0.5
第二部分非選擇題(共58分)
-
18.用ClO2消毒的飲用水中會含有ClO2、
和ClO-2,化學小組用如下方法測定預處理后的飲用水中ClO2、ClO-3和ClO-2的含量和總量(總氯)。ClO-3
資料:氧化性強弱:ClO2>>ClO-2;I2+2Na2S2O3═2NaI+Na2S4O6(Na2S2O3和Na2S4O6溶液顏色均為無色)ClO-3
Ⅰ.ClO2和含量的測定ClO-2
①向v1mL的飲用水中加入過量KI溶液,用amol/L Na2S2O3標準溶液滴定至終點。消耗Na2S2O3溶液v2mL;
②向①中反應后的溶液中,加入鹽酸調節溶液pH=2,充分反應后,繼續用amol/L Na2S2O3標準溶液滴定至終點,又消耗Na2S2O3溶液v3mL。
Ⅱ.總氯的測定
③向v1mL的飲用水中加入過量KBr溶液,加入濃鹽酸調節溶液pH=0.5,密封放置20min;然后加入過量KI溶液,立即用飽和磷酸氫二鈉溶液調節溶液pH=1.5。
④用amol/L Na2S2O3標準溶液滴定至終點,消耗Na2S2O3溶液v4mL。
⑤用v1mL的純水重復③~⑤,消耗Na2S2O3溶液v5mL。
(1)配制vmL amol/L Na2S2O3標準溶液,需稱量Na2S2O3固體g。
(2)①中滴定時所用的指示劑應該是,滴定至終點的現象是。
(3)②中加入鹽酸后發生反應的離子方程式是。
(4)磷酸氫二鈉(Na2HPO4)溶液呈堿性的原因是。(結合離子方程式和必要的文字說明)
(5)③中加入KI后發生反應的化學方程式是。
(6)水樣中的含量是ClO-3mg/L。
(7)測定總氯時不用KI直接反應,而是先加入KBr的原因是。組卷:9引用:2難度:0.5 -
19.某同學研究濃硝酸與KSCN溶液的反應。
資料:Ⅰ.SCN-中S、C、N元素的化合價依次為:-2價、+4價、-3價。
Ⅱ.SCN-的性質類似鹵素離子,能被氧化為黃色的(SCN)2,(SCN)2可聚合為紅色的(SCN)x。
Ⅲ.NO2可溶于濃硝酸。
實驗一: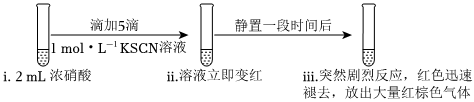
(1)向濃硝酸中滴加KSCN溶液,溶液立即變紅是因為生成了。(填化學式)
(2)研究SCN-的轉化產物。
實驗二:
a.將實驗一ⅲ中的氣體通入Ba(OH)2和NaOH的混合溶液中,有白色沉淀生成。
b.過濾、洗滌白色沉淀,取少量于試管中,加入過量的稀硝酸,沉淀完全溶解,再滴加少量KMnO4溶液,不褪色。
c.另取少量實驗一ⅲ中試管內的溶液加入BaCl2溶液,產生大量白色沉淀。
①通過b證實了紅棕色氣體中不含SO2,證據是。
②a中,Ba(OH)2溶液中加入NaOH溶液以增大OH-濃度的目的是。
③由上述實驗現象可知:SCN-轉化的最終產物中一定有。
(3)繼續研究實驗一ⅲ中“靜置一段時間后,突然劇烈反應,紅色迅速褪去”的原因。
實驗三: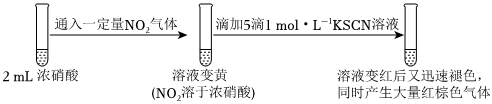
①對比實驗一和實驗三可得結論:一定濃度的NO2。
②結合實驗三,從化學反應速率的角度解釋實驗一ⅱ和ⅲ中的現象:。組卷:116引用:7難度:0.6


