2021-2022學年廣東省汕頭市金山中學高二(上)期中化學試卷
發布:2024/11/5 22:0:2
一、單項選擇題(本題共16小題,共44分。第1~10小題,每小題2分,共20分;第11~16小題,每小題2分,共24分。每小題只有一個最佳選項符合題意。)
-
1.下列物質的水溶液能導電,但屬于非電解質的是( )
A.CH3COOH B.Cl2 C.SO3 D.NH4HCO3 組卷:70引用:7難度:0.9 -
2.下列關于強弱電解質的敘述正確的是( )
A.NaHCO3是強電解質,其水溶液中不存在電離平衡 B.在溶液中導電能力強的電解質是強電解質,導電能力弱的電解質是弱電解質 C.強電解質既有離子化合物又有共價化合物 D.強電解質在液態時不能導電,在水溶液中能導電 組卷:77引用:2難度:0.7 -
3.下列各電離方程式中,書寫正確的是( )
A.NH4HCO3=NH4++HCO3- B.KHSO4?K++H++SO42- C.Fe(OH)3=Fe3++3OH- D.NaH2PO4=Na++2H++PO43- 組卷:96引用:1難度:0.3 -
4.下列關于電離平衡常數(K)的說法中正確的是( )
A.電離平衡常數(K)越小,表示弱電解質電離能力越弱 B.電離平衡常數(K)與溫度無關 C.不同濃度的同一弱電解質,其電離平衡常數(K)不同 D.多元弱酸各步電離平衡常數相互關系為:K1<K2<K3 組卷:101引用:24難度:0.7 -
5.25℃時,水的電離達到平衡:H2O?H++OH-;△H>0,下列敘述正確的是( )
A.向水中加入稀氨水,平衡逆向移動,c(OH-)降低 B.向水中加入少量固體硫酸氫鈉,c(H+)增大,Kw不變 C.向水中加入少量固體NaCl,平衡逆向移動,c(H+)降低 D.將水加熱,Kw增大,pH不變 組卷:154引用:8難度:0.7 -
6.工業上通過熔融狀態下的反應Na+KCl?NaCl+K來制取金屬鉀,反應溫度通常為850℃,有關數據如表所示,下列說法錯誤的是( )
Na K NaCl KCl 熔點/℃ 97.8 63.7 801.0 770 沸點/℃ 883 774 1413 1500 A.鉀比鈉活潑 B.該反應的ΔS>0 C.該反應的溫度可低于774℃ D.850℃條件下該反應ΔH-TΔS<0 組卷:20引用:6難度:0.7
二、非選擇題(本題共4小題,共56分)
-
19.運用化學反應原理研究碳、氮、硫的單質及其化合物的反應對緩解環境污染、能源危機具有重要意義。
(1)CO還原NO的反應為2CO(g)+2NO(g)?2CO2(g)+N2(g)△H=-746 kJ?mol-1。部分化學鍵的鍵能數據如下表:
①由以上數據可求得NO的鍵能為化學鍵 C≡O (CO的鍵) N≡N C=O E/(kJ?mol-1) 1076 945 745 kJ?mol-1。
②寫出兩條有利于提高NO平衡轉化率的措施。
(2)用焦炭還原NO的反應為:2NO(g)+C(s)?N2(g)+CO2(g)△H。恒容恒溫條件下,向體積相同的甲、乙、丙三個容器中分別加入足量的焦炭和一定量的NO,測得各容器中NO的物質的量[n(NO)]隨反應時間(t)的變化情況如下表所示:
①△Ht/min
n(NO)/mol
容器0 40 80 120 160 甲/400℃ 2.00 1.5 1.10 0.80 0.80 乙/400℃ 1.00 0.80 0.65 0.53 0.45 丙/T℃ 2.00 1.45 1.00 1.00 1.00 0(填“>”或“<”)。
②乙容器在160 min時v正v逆(填“>”、“<”或“=”)。
(3)某溫度下,向體積為2L的恒容真空容器中通入2.00 mol NO2,發生反應:
2NO2(g)?N2O4(g)△H=-57.0 kJ?mol-1
已知:v正(NO2)=k1?c2(NO2),v逆(N2O4)=k2?c(N2O4),其中k1、k2為速率常數。測得NO2的體積分數[?(NO2)]與反應時間(t)的關系如下表:
①t/min 0 20 40 60 80 φ(NO2) 1.0 0.75 0.52 0.50 0.50 的數值為k1k2。
②已知速率常數k隨溫度升高而增大,則升高溫度后k1增大的倍數k2增大的倍數(填“>”、“<”或“=”)。組卷:14引用:1難度:0.4 -
20.磷酸鐵鋰(LiFePO4)被認為是最有前途的鋰離子電池正極材料.某企業利用富鐵浸出液生成磷酸鐵鋰,開辟了處理硫酸亞鐵廢液一條新途徑.其主要流程如圖:
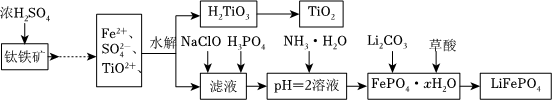
已知:H2LiO3是種難溶于水的物質.
(1)鈦鐵礦用濃硫酸處理之前,需要粉碎,其目的
(2)TiO2+水解生成H2TiO3的離子方程式
(3)加入NaClO發生反應的離子方程式
(4)在實驗中,從溶液中過濾出H2TiO3后,所得濾液渾濁,應如何操作.
(5)為測定鈦鐵礦中鐵的含量,某同學取經濃硫酸等處理的溶液(此時鈦鐵礦中的鐵已全部轉化為二價鐵離子),采取KMnO4標準液滴定Fe2+的方法:(不考慮KMnO4與其他物質反應)在滴定過程中,若未用標準液潤洗滴定管,則使測定結果. (填“偏高、偏低、無影響”),滴定終點的現象.滴定分析時,稱取a g鈦鐵礦,處理后,用cmol/LKMnO4標準液滴定,消耗VmL,則鐵元素的質量分數的表達式為.組卷:55引用:8難度:0.3


